Презентація "Хімія білків"
Про матеріал
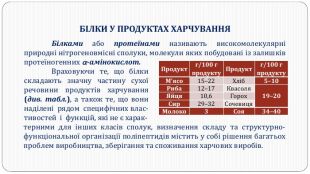
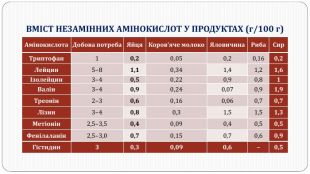
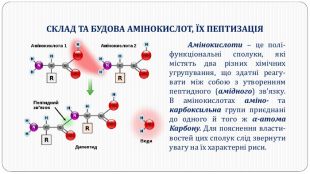
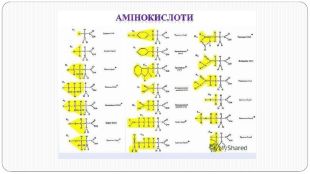
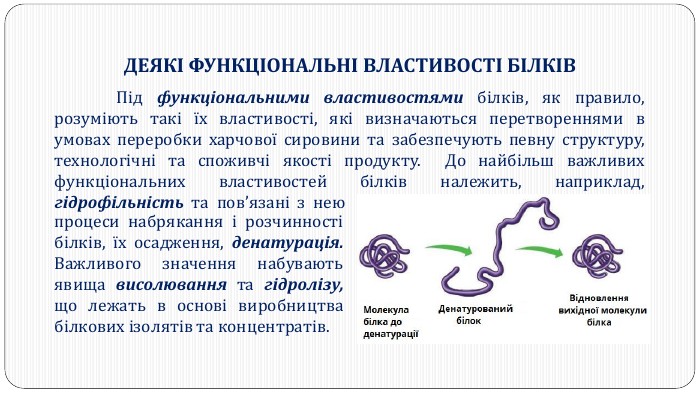
Перетворення білкових речовин харчової сировини у технологічному процесі та під час зберігання: денатурація, деструкція та взаємодія з іншими компонентами їжі. Функціональні властивості білків. Значення білків у життєдіяльності людини. Якісне визначення білків у продуктах харчування за допомогою кольорових реакцій. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



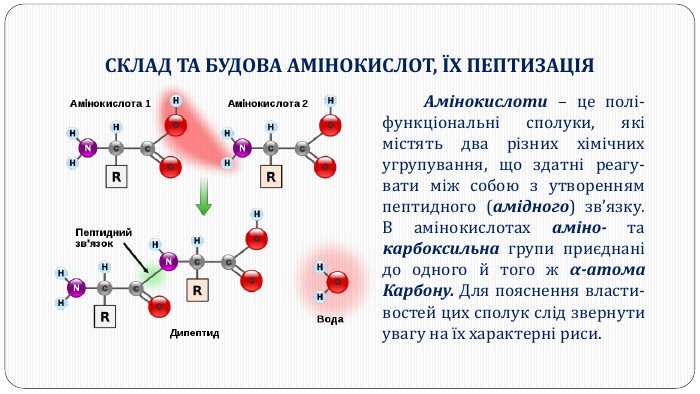
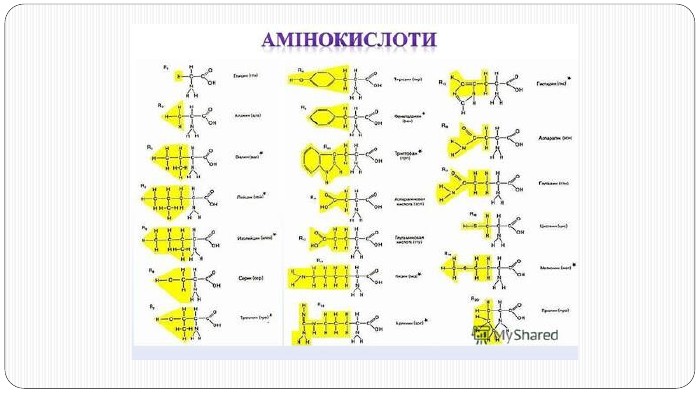
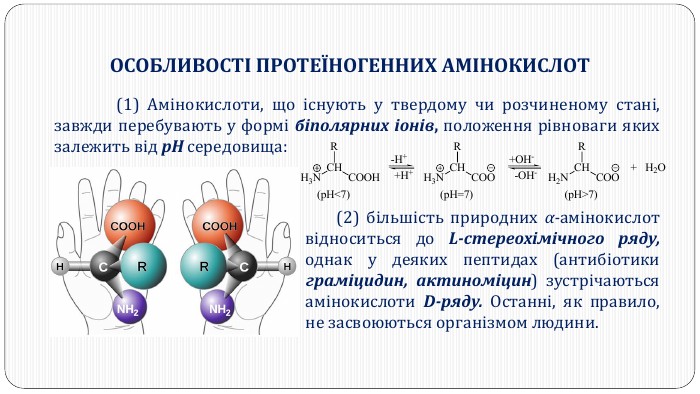
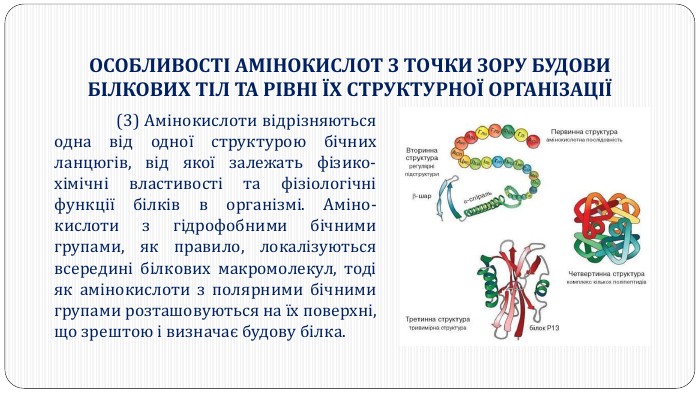




![Рекомендована література. Пищевая химия / А. П. Нечаев, С. Е. Траубенберг, А. А. Кочеткова и др. // Под ред. А. П. Нечаева; изд. 4-е, испр. и доп. – СПб.: ГИРД, 2007. – С. 17–121;Харчова хімія: [Навч. посібник] / Я. П. Скоробогатий, А. В. Гузій, О. М. Заверуха. – Львів: «Новий світ – 2000», 2012. – С. 327–346;Харчова хімія: Навч. посібник / В. В. Євлаш, О.І. Торяник, В. О. Коваленко та ін. – Х.: Світ книг, 2012. – С. 12–108;Харчова хімія: Навч. посібник / Л. В. Дуленко, Ю. А. Горяйнова, А. В. Полякова та ін. – К.: Кондор, 2012. – С. 196-211;Харчова хімія: [Навч. посібник] / О. П. Чигвінцева, А. В. Токар. – Дніпропетровськ: «Принтхаус Римм», 2015. – С. 32–77. Рекомендована література. Пищевая химия / А. П. Нечаев, С. Е. Траубенберг, А. А. Кочеткова и др. // Под ред. А. П. Нечаева; изд. 4-е, испр. и доп. – СПб.: ГИРД, 2007. – С. 17–121;Харчова хімія: [Навч. посібник] / Я. П. Скоробогатий, А. В. Гузій, О. М. Заверуха. – Львів: «Новий світ – 2000», 2012. – С. 327–346;Харчова хімія: Навч. посібник / В. В. Євлаш, О.І. Торяник, В. О. Коваленко та ін. – Х.: Світ книг, 2012. – С. 12–108;Харчова хімія: Навч. посібник / Л. В. Дуленко, Ю. А. Горяйнова, А. В. Полякова та ін. – К.: Кондор, 2012. – С. 196-211;Харчова хімія: [Навч. посібник] / О. П. Чигвінцева, А. В. Токар. – Дніпропетровськ: «Принтхаус Римм», 2015. – С. 32–77.](/uploads/files/2363947/348662/400741_images/14.jpg)