Презентація. "Кислоти"
Про матеріал
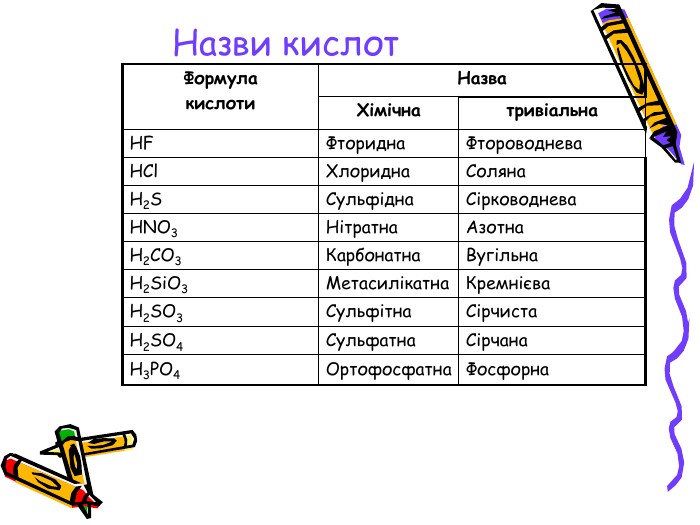
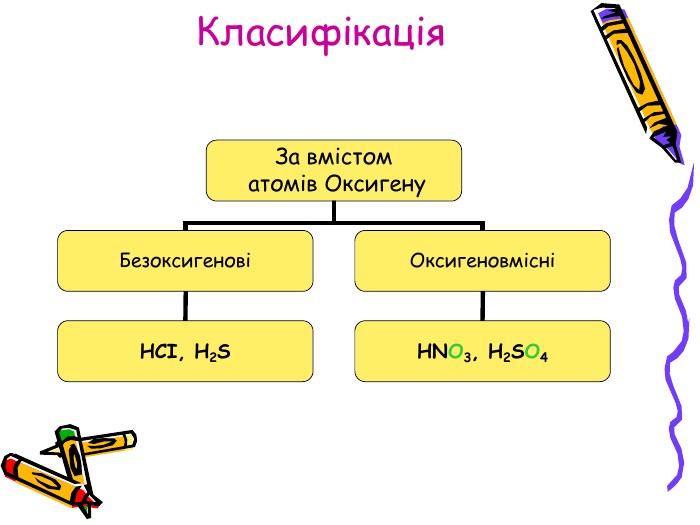
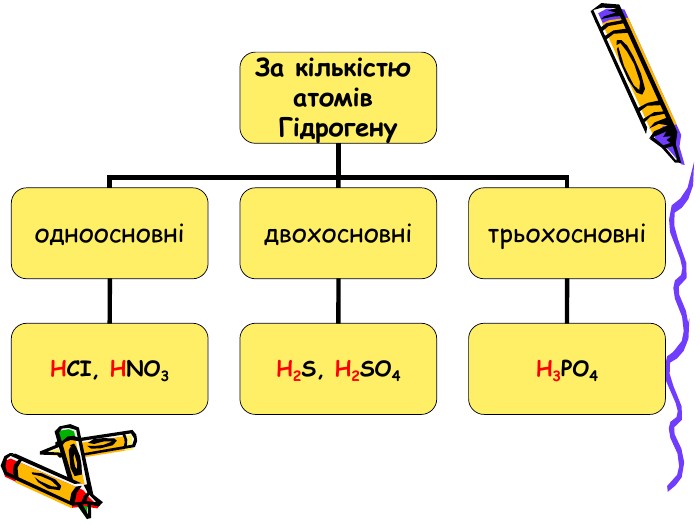
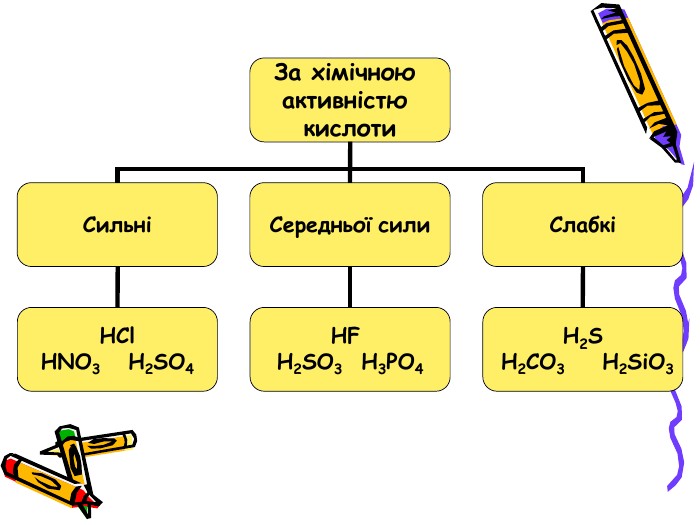
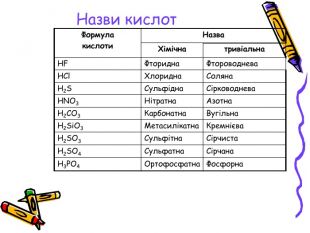
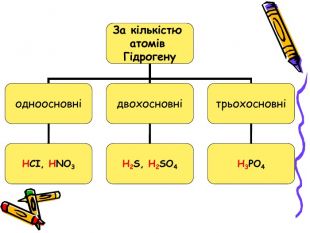
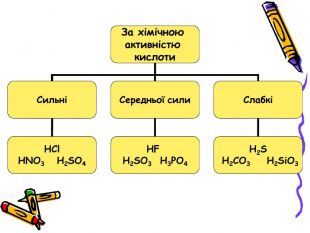
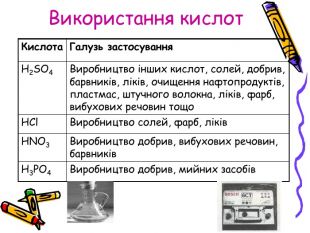
Презентація для учнів 8 класу на тему "Кислоти, їх склад, класифікація та застосування Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку