Урок "Основи: їх склад, назви, класифікація."
Тема . Основи, їх склад, назви, класифікація.
Мета: на основі відомого матеріалу сформувати перше поняття про основи як гідроксиди металів, пояснити їх склад та назви; ознайомити з класифікацією основ за розчинністю у воді; з фізичними властивостями; виявити спільне у хімічному складі лугів і нерозчинних основ і дати визначення основ; сформувати уміння складати формули основ, використовуючи знання про валентність металів і гідроксогрупи, класифікувати основи за їх розчинністю у воді; виховати повагу до думки іншого, інтерес до предмета.
Тип уроку : вивчення нового матеріалу
Хід уроку
І. Організаційний момент. Вправа «Посмішка». Учні, даруючи посмішку, вітаються один з одним, бажаючи гарного настрою та вдалогл уроку .
ІІ . Актуалізація опорних знань
1.Знайди відповідність:
1. Основні оксиди А. CaO Г. SnO
2. Амфотерні оксиди Б. SO2 Д. FeO
3. Кислотні оксиди В. ZnO Ж. CO2
2.Хімічний диктант: Записати формули оксидів ,кислот за назвами: сульфатна кислота, натрій оксид, кальцій оксид, алюміній оксид, хлоридна кислота, ортофосфатна кислота, ферум (ІІ) оксид, літій оксид, ферум (ІІІ) оксид, карбон (ІV) оксид, калій оксид.
3. Гра «Хрестики-нулики»
Виграшний шлях складають формули:
Варіант 1: основних оксидів. Варіант 2: кислотних оксидів.
|
ВаО |
P2O5 |
Na2O |
|
N2O |
Li2O |
SO3 |
|
SiO2 |
BeO |
CаO |
|
СаО |
SiO2 |
СrO3 |
|
FeO |
N2O3 |
СО |
|
TeO3 |
P2O5 |
MgO |
Варіант 3. Одноосновні безоксигенові кислоти
|
HCl |
HBr |
HI |
|
HNO3 |
H2S |
H2SO3 |
|
H2SiO3 |
H2SO4 |
H3PO4 |
ІV. Пояснення нового матеріалу
- Поняття основи та їх гідроксильна група.
Основи – це сполуки, до складу яких входять атом металічного елемента й одна або кілька гідроксильних груп OH (залежно від валентності металу).
Основи – сполуки, які містять катіони металічних елементів і гідроксид- аніони ОН–.
Загальна формула основ: Me(OH)n, де n – число груп OH, що відповідає валентності металічного елемента. Me – символ металічного елемента.
Назва основ
Назва основ складається з двох слів, перше з яких – назва металічного елемента, а друге – «гідроксид».
Наприклад, KOH – калій гідроксид, Ba(OH)2 – барій гідроксид.
Щоб скласти формулу основи за назвою, спочатку пишуть знак металу, потім – гідроксильну групу і складають формулу за валентністю:
ІІ І ІІІ І
Магній гідроксид - Мg(ОН)2 ; Ферум (ІІІ) гідроксид – Fе (ОН)3
Формула основи |
Систематична назва |
Традиційна назва |
NaOH |
Натрій гідроксид |
“їдкий натр”, “каусти-чна сода” |
|
KOH |
Калій гідроксид |
“Їдкий калій” |
|
Ca(OH)2 |
Гідроксид кальцію |
“гашене вапно” |
|
Ba(OH)2 |
Гідроксид барію |
“їдкий барит” |
Фізичні властивості основ
Основи за звичайних умов є твердими речовинами йонної будови, тому вони повинні мати високу температуру плавлення, але при помірному нагріванні майже всі основи розкладаються на відповідний оксид і воду. Розплавити можна лише гідроксиди натрію і калію. Більшість основ не розчиняються у воді. Малорозчинними є гідроксиди малоактивних металічних елементів, а добре розчинні гідроксиди лужних елементів і сполуки барію. Водорозчинні основи називають лугами.
Класифікація основ

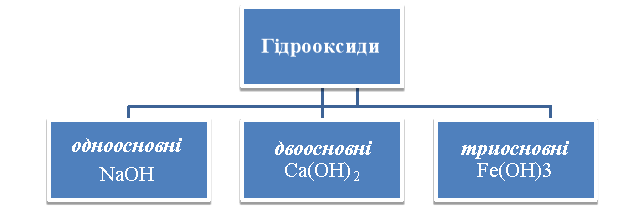
За звичайних умов луги – це тверді кристалічні речовини, милкі на дотик, роз’їдають багато матеріалів, шкіру, папір, тканину, добре розчиняються у воді. Змінюють колір індикаторів: лакмус (фіолетовий) змінюється на синій; метиловий оранжевий (оранжевий) – на жовтий; фенолфталеїн (безбарвний) забарвлюється в малиновий колір.
Нерозчинні основи – тверді речовини, не милкі на дотик, не роз’їдають шкіру, не мають запаху, практично не розчиняються у воді й не змінюють кольору індикаторів.
Забарвлені вони по-різному:
купрум(II) гідроксид Cu(OH)2 – блакитний;
Zn(OH)2, Al(OH)3 – білі,
Fe(OH)2 – зеленувато-білий,
ІV.Закріплення знань
Парна робота
1) Написати формули речовин: берилій гідроксиду, барій гідроксиду, стронцій гідроксиду, кальцій гідроксиду, нікель (ІІ) гідроксиду, натрій гідроксиду, хром (ІІІ) гідроксиду. ( взаємоперевірка)
2) Написати назви основ відповідно до формули речовин: Zn(OH)2, Cu(OH)2 ,
LiOH, Mg(OH)2, Fe(OH)2, КОН . ( взаємоперевірка)
Колективна робота
Завдання.1 Користуючись таблицею розчинності, наведіть формули і назви розчинних і нерозчинних гідрооксидів.
Завдання.2 Користуючись таблицею розчинності, наведіть формули і назви одноосновних, двоосновних та трьохосновних гідрооксидів.
Індивідуальна робота вправа«Так – ні»
1.Основи - складні речовини немолекулярної будови, хімічна формула яких складається із одного атому металу та однієї чи кількох гідроксильних груп.
2. Число одновалентних гідроксильних груп у формулі основи залежить від валентності металу
3.Загальна формула основ: Меm(ОН)n
4.Сучасна назва основ складається з назви металу з додаванням слова “оксид”
5.Якщо метал проявляє змінну валентність, то після назви металу в дужках зазначається його валентність
6.За звичайних умов основи перебувають у твердому стані, частина з них добре розчиняється у воді.
7. Нерозчинні у воді основи – луги.
8.Основи класифікують на кислотні та солетворні.
9.Луги милкі на дотик
10. Луги не змінюють колір індикаторів.
VI. Підсумок уроку
Яку тему ми розглядали на сьогоднішньому уроці?
Що нового ви дізналися для себе із сьогоднішнього уроку?
VII. Виставлення оцінок. Домашнє завдання.

про публікацію авторської розробки
Додати розробку
