Презентація "Користь та шкода нітратів"
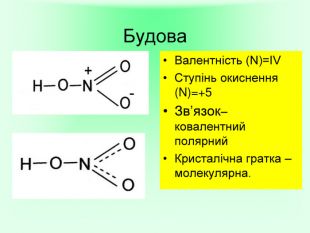
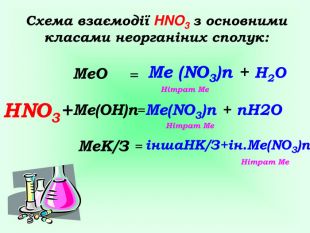
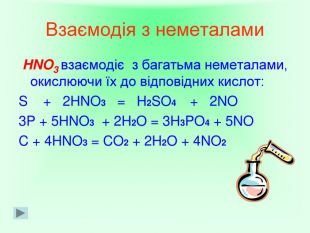
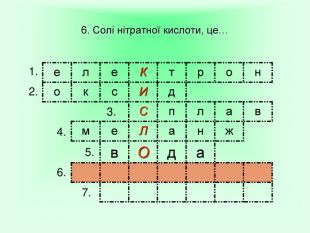
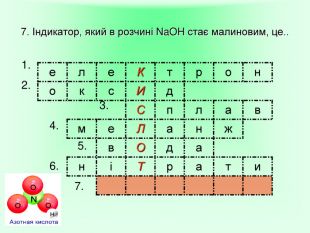
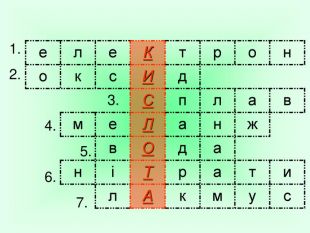
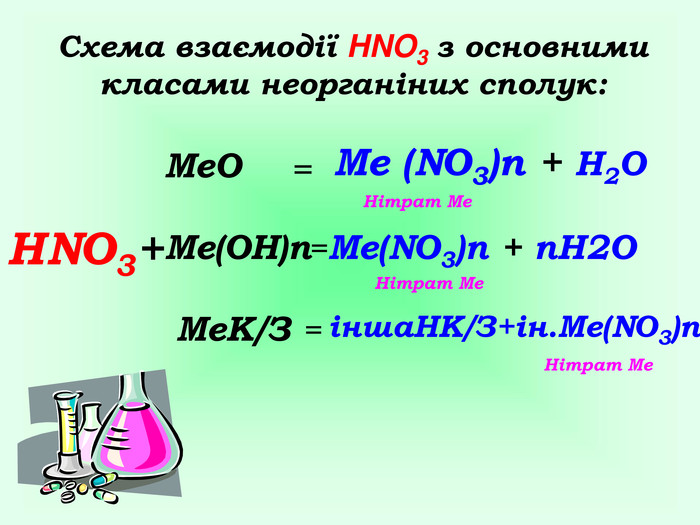
Презентація на тему "Нітрати. Користь та шкода". Показано мету роботи, властивості нітратної кислоти та її солей.Надає можливість урізноманітнити викладання теми "Солі" у 8 класі, у 9 класі при вивченні теми Йонні рівняння, окисно - відновні реаціїї.













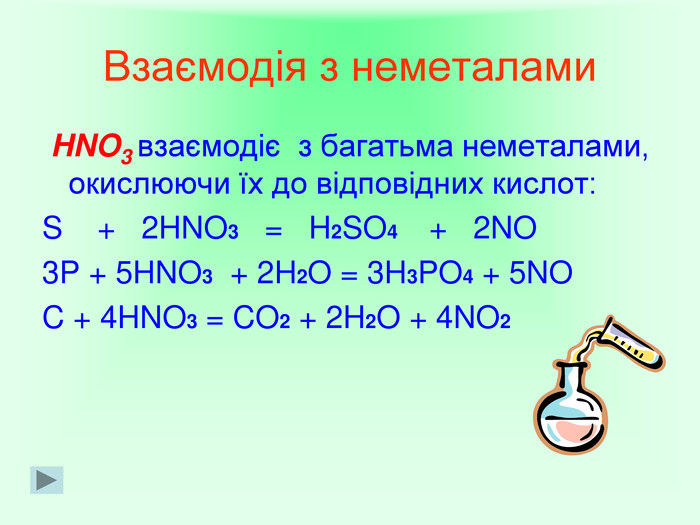

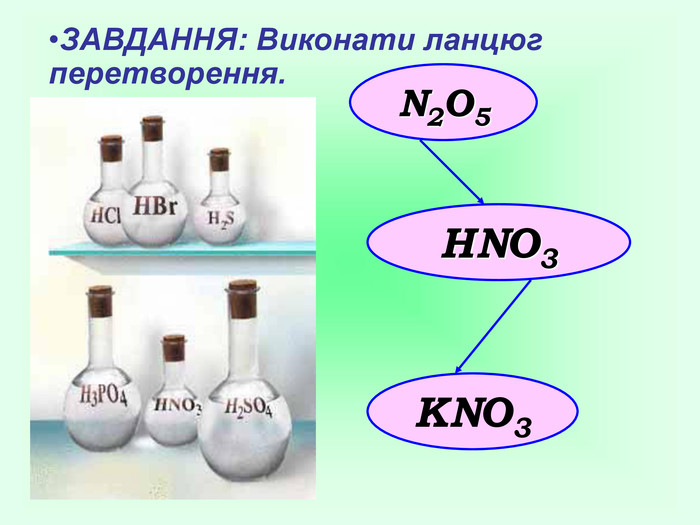

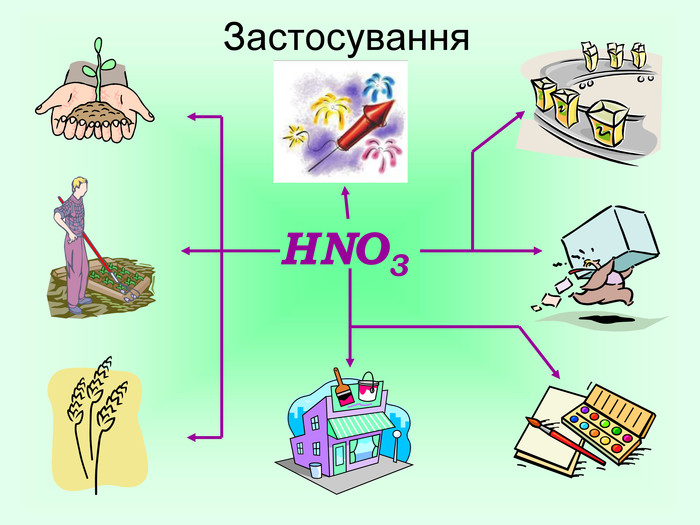







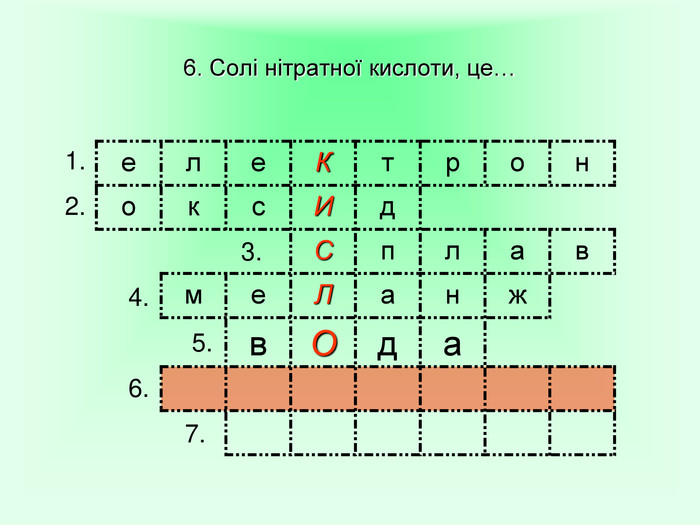
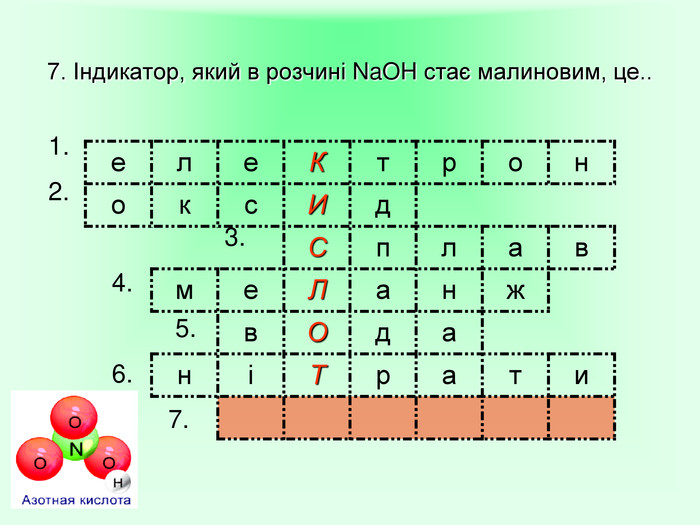
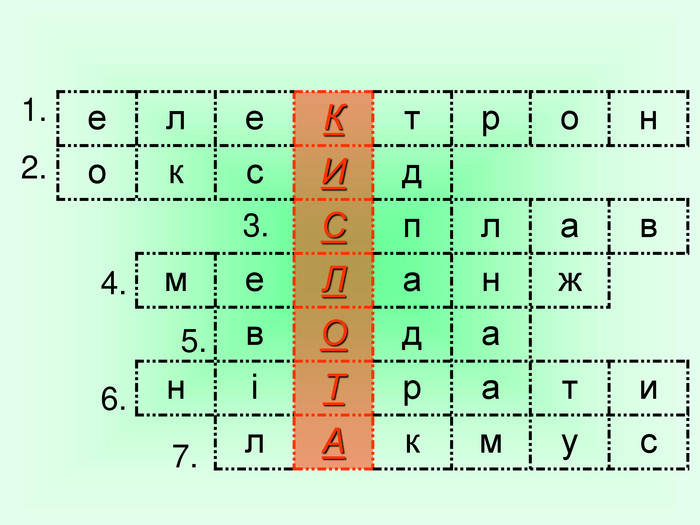
Завдання для роботи учнів в парах «Хімічний кислотний опік» Завдання: Час виконання 3 хвилини. Кислоти є їдкими речовинами, нітратна кислота – не виняток. Запропонуйте варіант надання першої медичної допомоги при опіку розчином HNO3. (Згадайте знання з розділу «Організм людини» курсу біології.) Якими з речовин (розчином NaOH, розчином NaHCO3сода, кристалами лимонної кислоти) ви нейтралізуєте кислоту, щоб не було сильного опіку? Як юний талановитий хімік поясніть правомірність ваших дій і складіть рівняння хімічної реакції, що забезпечує нейтралізацію кислоти на шкірі.

про публікацію авторської розробки
Додати розробку