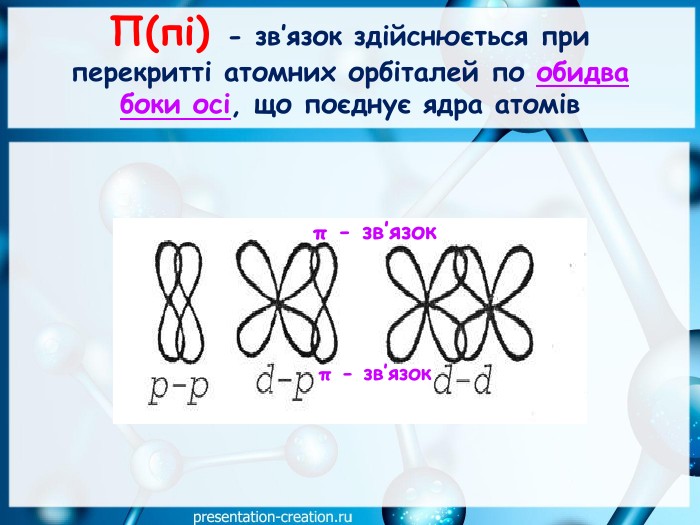
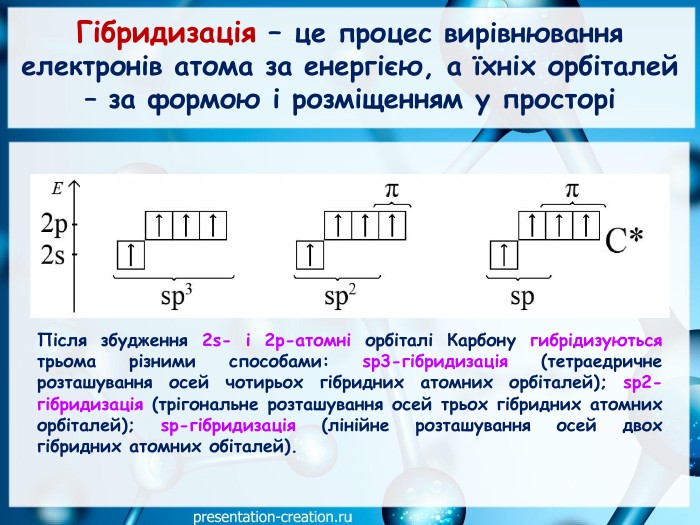
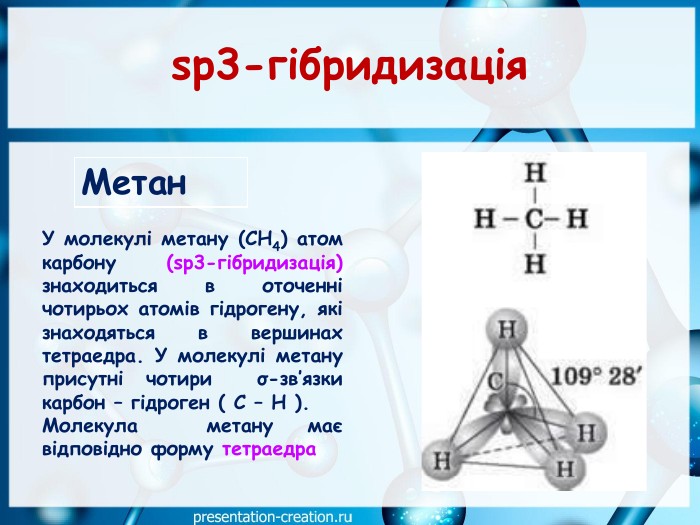
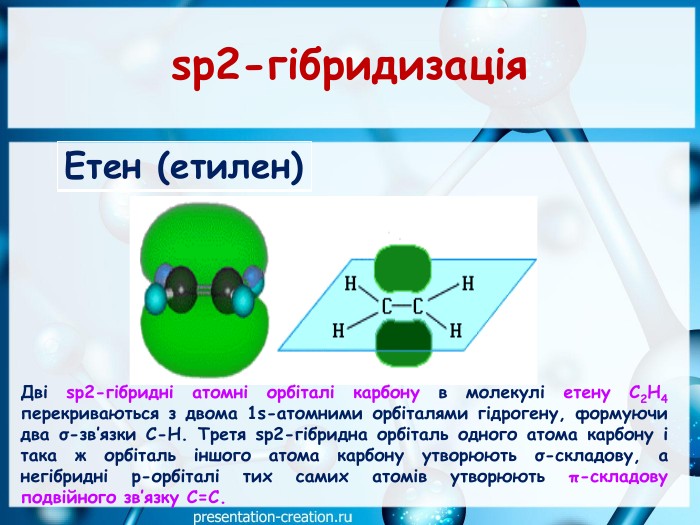
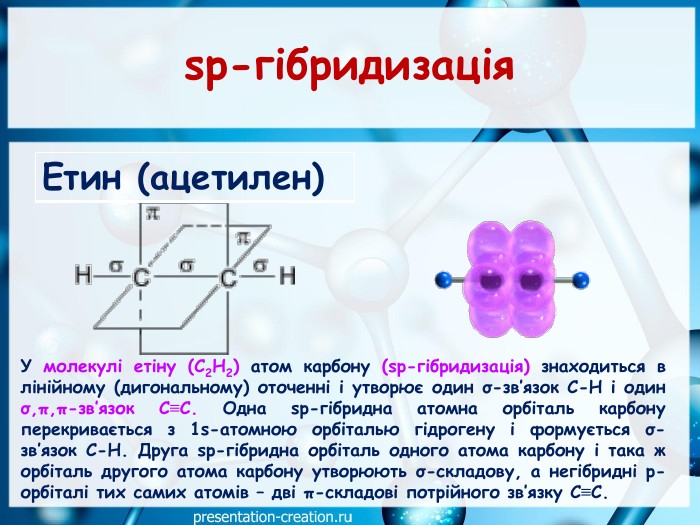
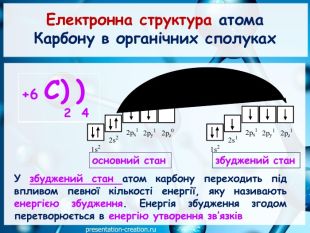
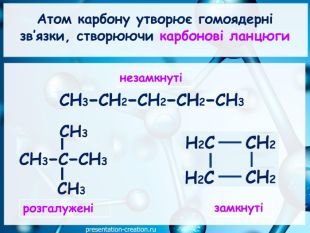
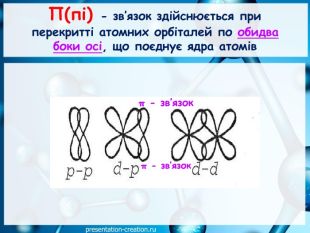
Презентація: "Ковалентні карбон-карбонові зв’язки у молекулах органічних сполук: простий, подвійний, потрійний."
Про матеріал
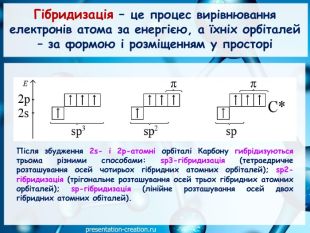
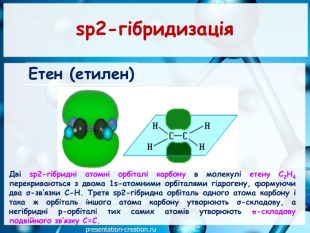
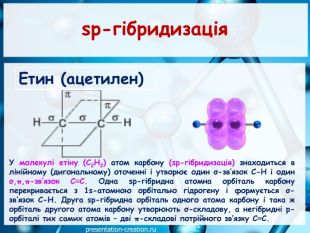
Дана презентація складена, як допоміжний матеріал, для проведення уроку хімії в 10 класі за темою: "Ковалентні карбон-карбонові зв’язки у молекулах органічних сполук: простий, подвійний, потрійний.". Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
дякую!
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку