Презентація Єлектроліти в сучасних акумуляторах


























Практическое значение. Электри́ческий аккумуля́тор — устройство для накопления электрической энергии путем превращения ее в химическую и по мере надобности с обратным преобразованием. Электрический аккумулятор является химическим источником электрического тока многоразового пользования, работоспособность которого может быть восстановлена путем заряжания — пропусканием тока в направлении, обратном направлению тока при разряде.
Мало кто вспоминает об электрических батареях до того момента, когда они разряжаются. Но эта утилитарная и неожиданно древняя технология дала очень многое человеческой цивилизации. Фактически, современный мир не существовал бы в своём сегодняшнем виде, если бы не батареи с их совершенно уникальной способностью хранить и отдавать электрическую энергию. Без батарей не было бы мобильной электроники, любых компактных электроприборов, включая фонарики. Мы были бы намертво «привязаны» к стационарным розеткам. Давайте вместе вспомним историю появления этой технологии, оценим её сегодняшнее состояние и попробуем спрогнозировать дальнейшее развитие.
Исторический экскурс. Багдадская батарея. В 1936 году в развалинах деревни в окрестностях Багдада были обнаружены покрытые чем-то странным терракотовые кувшины. Их возраст был датирован либо эпохой Парфянского царства, либо Сасанидской империи. Назначение кувшинов осталось неизвестным, и их отдали в Национальный Музей Ирака. 2 года спустя они попались на глаза германскому археологу Вильгельму Кёнигу. Через некоторое время он опубликовал отчёт, в котором предположил, что эти кувшины — предшественник гальванического элемента.
Багдадская батарея. Кувшины были высотой 14 см, внутри находилась маленькая медная трубка (свёрнутая из листа). В трубку с помощью асфальтовой пробки был вставлен ржавый железный пруток. Кувшин мог заполняться раствором кислоты или щёлочи: лимонным, виноградным соком или уксусом. Исследователи считают, что такая батарея давала слабое, но стабильное напряжение от 0,8 до 2 В. Также есть мнение, что эти кувшины использовались в религиозных или целительных церемониях. В древности электрические батареи вообще часто использовались как средство лечения, поскольку были таинственным явлением, загадкой жизни. Но и по сей день не обнаружено аналогов Багдадской батареи, так что медицинская версия в отношении неё ничем не подкреплена.
Гальванический элемент. Как вы знаете из курса школьной биологии, лягушачьи лапки используются для демонстрации сокращения мышц под действием электрического тока. Это явление в 1771 году открыл Луиджи Гальвани, профессор Болонского Университета. Согласно легенде, он снимал с лягушки кожу, приколов медными булавками к столу, на котором перед этим проводил эксперименты со статическим электричеством. Ассистент Гальвани взял со стола скальпель (который, по случайности, был заряжен во время предыдущего опыта) и прикоснулся к оголённому нерву лягушки. Возникла искра, нога дёрнулась, а Гальвани осенило, что электрический заряд переносится ионами.
На самом деле, он не думал так в буквальном смысле. Гальвани решил, что «животное электричество», само рождающееся в тканях, передаётся «электрическими флюидами». Этот ошибочный взгляд продержится в науке около 30 лет. Тем не менее, открытие Гальвани положило начало современным батареям и получило название «гальванический элемент». Гальвани придерживался мнения относительно происхождения электричества в живых существах до конца жизни. Он считал, что его производят бедренные мышцы. Одним из первых современников Гальвани, воспроизведшим его опыт, стал Алессандро Джузеппе Антонио Вольта, профессора экспериментальной физики в Университете Павии. Вольта обратил внимание, что лапки лягушки не только реагировали на электричество, но и проводили его.
Вольтов столб. Для доказательства этого профессор собрал установку, состоящую из стопки серебряных и цинковых дисков, разделённых пропитанной рассолом тканью. Вольта хотел сделать эту стопку как можно более высокой. Так на свет появился «вольтов столб», первая в мире электрическая батарея. Благодаря «столбу» Вольта открыл и закон имени себя о разности потенциалов.«Вольтов столб» повлёк за собой ряд открытий, сделанных другими учёными, например, явление электролиза. В качестве электролитов стали использовались различные жидкости, в том числе раствор соляной кислоты.
Самая значительная модификация изобретения Вольты была создана в 1866 году. Жорж Лекланше поместил цинковый анод и катод из диоксида марганца и углерода в раствор хлорида аммония. В результате возникало напряжение 1,4 В (оригинальный «столб» позволял достичь 0,4 В). Это эквивалентно напряжению современных алкалиновых батареек. Изобретение Лекланше использовалось в первых телефонных системах и положило начало современным батареям на сухих элементах, которые используются в большинстве гаджетов.
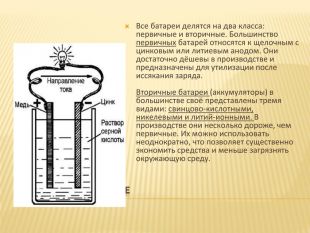
Видовое разнообразие. Все батареи делятся на два класса: первичные и вторичные. Большинство первичных батарей относятся к щелочным с цинковым или литиевым анодом. Они достаточно дёшевы в производстве и предназначены для утилизации после иссякания заряда. Вторичные батареи (аккумуляторы) в большинстве своё представлены тремя видами: свинцово-кислотными, никелевыми и литий-ионными. В производстве они несколько дороже, чем первичные. Их можно использовать неоднократно, что позволяет существенно экономить средства и меньше загрязнять окружающую среду.
Батареи классифицируются не только по возможности повторного использования, но и по типу используемых элементов:• Гальванические (жидкостные) элементы. Старейший тип батарей, использующий жидкий электролит для «транспортировки» ионов. Широко применяются в автомобилестроении и для питания различных домашних устройств.• Сухие элементы. Устроены почти так же, как гальванические, за исключением отсутствия жидкости в их составе: электролит содержится в виде влажной пасты, что гораздо безопаснее. Могут применяться для создания первичных и вторичных батарей.• Элементы с солевым расплавом. Применяются в промышленности. В них соль нагрета до температуры плавления и эта жидкость играет роль электролита. Такое решение позволяет достичь высокой электрической ёмкости батарей.• Резервные элементы. Ёмкость с электролитом отделена от элементов, что позволяет хранить их длительное время без потери заряда. Такие конструкции чаще всего используются в научных и военных целях.
Что объединяет между собой все виды батарей? Тот факт, что все они являются вариациями вольтова элемента, генерирующего электричество благодаря протеканию химической реакции. Каждый элемент условно состоит из трёх компонентов: двух электродов и электролита, через который протекают ионы в ходе окислительно-восстановительной реакции.
Продолжительность работы батареи существенно зависит от её типа и вида прибора, в котором она используется. Например, первичные щелочные батареи обычно имеют более высокую максимальную ёмкость, но на деле достигают её тогда, когда потребление тока достаточно слабое: в детекторах дыма, детских игрушках и т.д. Литиевые вторичные батареи, с другой стороны, обычно имеют несколько меньшую ёмкость, но работают дольше и стабильнее в устройствах с высоким потреблением, например, цифровых камерах. Давайте рассмотрим подробнее каждый вид батарей.
Первичные. Щелочные батареи являются самыми распространёнными, они занимают около 70% рынка. По данным на 2011 год в мире было произведено 10 млрд штук. Чаще всего в этих батареях анод изготовлен из цинковой пудры, что увеличивает общую площадь поверхность и способствует протеканию тока. Катод обычно изготавливается из смеси диоксида марганца и углерода. В отличие от остальных батарей с цинковым анодом, в щелочных в качестве электролита используется гидроксид калия, а не хлорид аммония или цинка. Поэтому щелочные батареи имеют более высокую удельную ёмкость, дольше служат и хранятся (3-5 лет, обычные цинковые — 2-3 года). Первоначально напряжение составляет 1,55—1,7 В, постепенно снижаясь до 0,8. Низкая температура очень слабо сказывается на работоспособности.
Самыми дешёвые в производстве первичные элементы — сухие углеродно-цинковые. Зачастую бесплатно идут в комплекте с основным товаром. Целесообразнее всего использовать их в устройствах с низким и средним энергопотреблением: пультах ДУ, фонарях, часах. Отличаются низкой продолжительностью работы. У хлорид-цинковых элементов удельная ёмкость примерно на 50% выше, чем у углеродно-цинковых. Они на 20% тяжелее, гораздо дольше работают при высоком потреблении энергии, дольше хранятся, лучше сохраняют заряд при низкой температуре. Существует отдельный вид щелочных батарей, в которых анод изготовлен из лития или его сплавов. Катод из диоксида марганца погружён в электролитическую пасту из растворённых солей лития. У батарей типоразмеров АА и ААА напряжение может колебаться от 1,5 до 3,7 В. Литиевые щелочные батареи работают примерно вдвое дольше щелочных в условиях высокого энергопотребления, благодаря высокой ёмкости и низкому внутреннему сопротивлению. Срок хранения достигает 10 лет. Но всё это отражается на их цене.
Как наиболее эффективно использовать первичные батареи? Во-первых, хранить их лучше в холодильнике. Это позволяет замедлить химическую реакцию, протекающую в батареях, и продлить срок хранения примерно на 5%. Не забудьте положить их в пакет без доступа влаги, чтобы не корродировали. Перед использованием дайте время нагреться до комнатной температуры. Некоторые производители, напротив, рекомендуют хранить батареи при температуре 18-25 градусов Цельсия и относительной влажности 35-65%. При этих условиях щелочные батареи хранятся 5-7 лет, углеродно-цинковые — 3-5, литиевые — 10-15 лет. Избегайте хранения первичных батарей при температуре свыше 25 градусов, это сильно ускоряет их саморазряд. Никогда не пытайтесь их зарядить, это приведёт к взрыву. А брызги горячего электролита принесут вам мало удовольствия.
Вторичные. У этого типа батарей — аккумуляторов — есть возможность направить в противоположную сторону протекание химической реакции. Для этого необходимо принудительно поменять и направление протекания тока. Как уже упоминалось, есть три основных вида аккумуляторов: свинцово-кислотные, никелевые и литий-ионные. Они очень широко используются во множестве сфер, от сотовых телефонов до вычислительных центров.
Никелевые аккумуляторы делятся на никель-кадмиевые (Ni. Cd) и никель-металлгидридные (Ni. MH). В первых электроды изготовлены из гидрата закиси никеля и кадмия. Никель-кадмиевые аккумуляторы выдают напряжение около 1,2 В, хорошо работают при низкой температуре, ёмкость и срок службы не снижаются при высоком энергопотреблении. Однако у них довольно короткий срок хранения заряда. Гораздо шире распространены никель-металлгидридные аккумуляторы. Анод вместо кадмия изготовлен из сплава редкоземельных металлов (лантана, церия, неодима и празеодима). В качестве электролита используется гидроксид калия. При напряжении в 1,2 В, ёмкость Ni. MH-аккумуляторов в 2-3 раза выше, чем у Ni. Cd, и сравнима с литий-ионными.
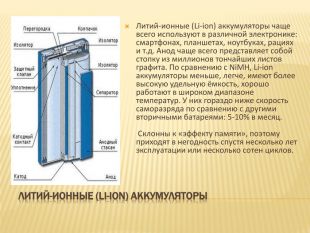
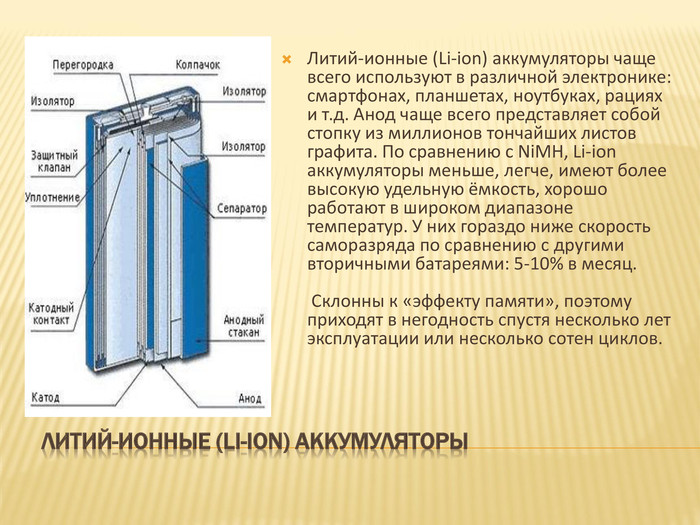
Литий-ионные (Li-ion) аккумуляторы. Литий-ионные (Li-ion) аккумуляторы чаще всего используют в различной электронике: смартфонах, планшетах, ноутбуках, рациях и т.д. Анод чаще всего представляет собой стопку из миллионов тончайших листов графита. По сравнению с Ni. MH, Li-ion аккумуляторы меньше, легче, имеют более высокую удельную ёмкость, хорошо работают в широком диапазоне температур. У них гораздо ниже скорость саморазряда по сравнению с другими вторичными батареями: 5-10% в месяц. Склонны к «эффекту памяти», поэтому приходят в негодность спустя несколько лет эксплуатации или несколько сотен циклов.
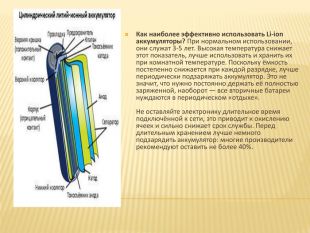
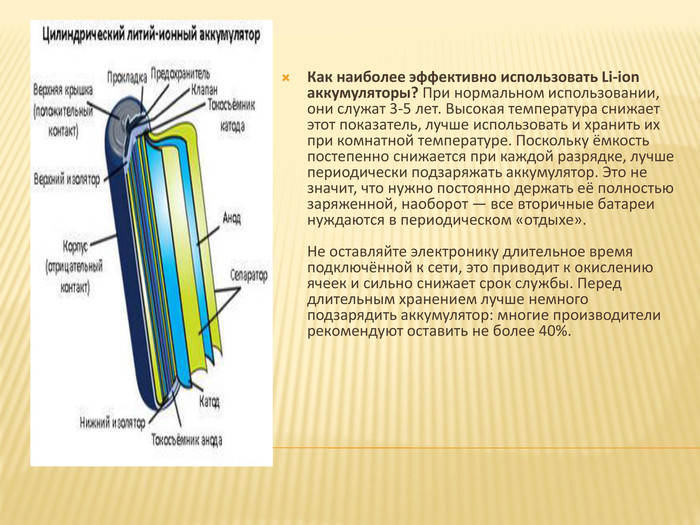
Как наиболее эффективно использовать Li-ion аккумуляторы? При нормальном использовании, они служат 3-5 лет. Высокая температура снижает этот показатель, лучше использовать и хранить их при комнатной температуре. Поскольку ёмкость постепенно снижается при каждой разрядке, лучше периодически подзаряжать аккумулятор. Это не значит, что нужно постоянно держать её полностью заряженной, наоборот — все вторичные батареи нуждаются в периодическом «отдыхе». Не оставляйте электронику длительное время подключённой к сети, это приводит к окислению ячеек и сильно снижает срок службы. Перед длительным хранением лучше немного подзарядить аккумулятор: многие производители рекомендуют оставить не более 40%.
Автомобильный аккумулятор. На легковых автомобилях в качестве стартерных применяются свинцово-кислотные аккумуляторные батареи. Конструкция аккумуляторных батарей постоянно совершенствуется. Схема аккумуляторной батареи. Каждая батарея состоит из шести последовательно соединенных аккумуляторов, объединенных в одном корпусе. Корпус изготавливается из пропилена, стойкого к кислоте и не проводящего ток. Отдельный аккумулятор объединяет чередующиеся положительные и отрицательные электроды, покрытые слоем активной массы. Изоляцию пластин противоположной полярности обеспечивает пластмассовый сепаратор.
Автомобильный аккумулятор. Электроды помещены в электролит, в качестве которого используется раствор серной кислоты. Электролит имеет определенную плотность, которая изменяется в зависимости от степени заряженности аккумуляторной батареи (чем выше заряженность, тем выше плотность). В зависимости от физического состояния электролита различают два вида аккумуляторных батарей: с жидким электролитом и с пропитавшим специальный материал (нежидким) электролитом. Сегодня наиболее распространены аккумуляторные батареи с жидким электролитом.
Работа аккумуляторной батареи. Принцип действия аккумуляторной батареи основан на преобразовании электрической энергии в химическую энергию при заряде и наоборот химической энергии в электрическую при разряде. Работа аккумуляторной батареи носит циклический характер: разряд-заряд. Разряд происходит при подключении потребителей. При разряде активная масса положительных (диоксид свинца) и отрицательных (губчатый свинец) электродов взаимодействует с электролитом. Срок службы аккумуляторной батареи составляет в среднем 4-5 лет и во многом зависит от режима эксплуатации.
Выводнаиболее эффективным способом увеличения времени автономной работы мобильных устройств , аккумуляторов сегодня является вовсе не изобретение новых источников питания, а усовершенствование старых перспективных источников питания, которые в скором времени могут сменить существующие технологии.


про публікацію авторської розробки
Додати розробку