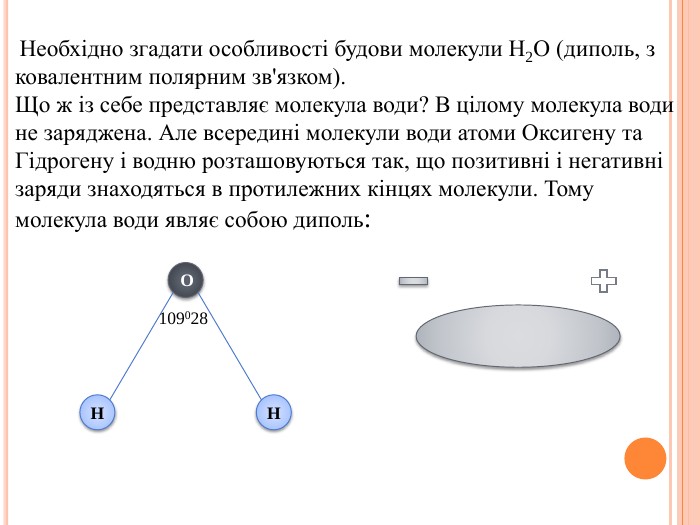
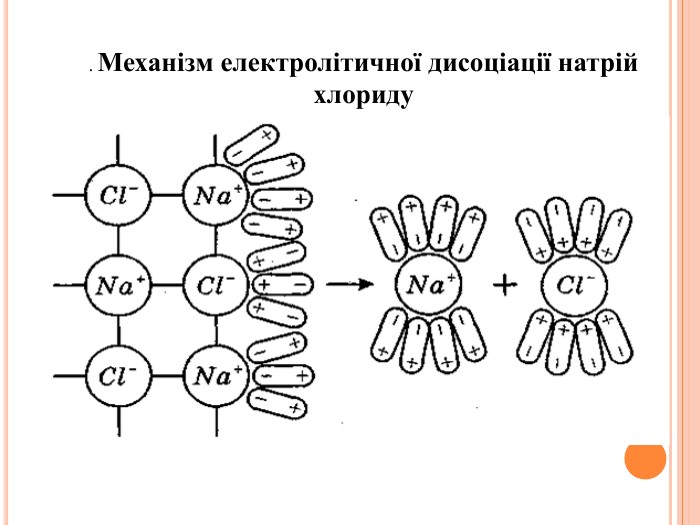
Презентація на тему "Електроліти та неелектроліти. Електролітична дисоціація."
Про матеріал
Пропоную добірку матеріалів до уроку в 9 класі по темі "Електроліти та неелектроліти. Електролітична дисоціація". Інформація до цієї теми оформлена у формі презентації. В презентації розміщено досить багато інформації та цікавих ілюстрацій, корисних для підготовки до уроку за темою "Електроліти та неелектроліти. Електролітична дисоціація". Дана презентація може бути цікавою для вчителів хімії. Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку