Презентація до уроку "Ступінь дисоціації. Сильні та слабкі електроліти"
Про матеріал
Пропоную добірку матеріалів до уроку в 9 класі по темі "Ступінь дисоціації. Сильні та слабкі електроліти". Інформація до цієї теми оформлена у формі презентації. В презентації розміщено досить багато інформації та цікавих ілюстрацій, корисних для підготовки до уроку за темою " Ступінь дисоціації. Сильні та слабкі електроліти ". Інформація, яка розміщена в цій презентації, може бути цікавою для вчителів хімії. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую! Стисло, конкретно, наочно.
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку









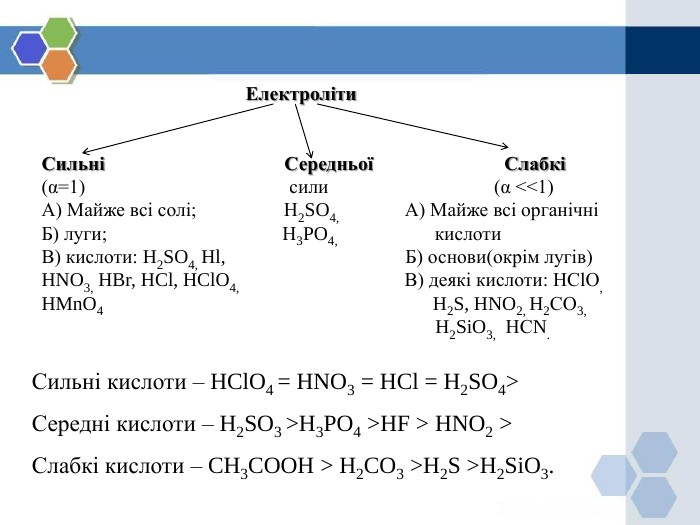
![Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається де 0. Адже з кожного мільярда (1 000 000 000) молекул води на йони розгадаються лише дві. Вочевидь такої кількості йонів замало, аби забезпечити бодай трохи помітну електропровідність дистильованої води. Н2 О Н2 О Н+ + ОН- або 2 Н2 О Н3 О + + ОН- Н3 О + - йон гідроксонію. У 1 л води при t = 220 С дисоціює 10 -7 моль води, утворюється 10 -7 моль/л йонів Н+ і 10 -7 моль/л йонів ОН- .[Н+ ] = [ОН-] = 10 -7 моль -> нейтральне середовище;[Н+ ] > 10 -7 моль -> кисле середовище;[Н+ ] < 10 -7 моль -> лужне середовище;Ступінь дисоціації (α) – кількісна характеристика процесу дисоціації: n (число частинок, що розпалися)α = ———————————————————— N (загальне число молекул)Одиниці вимірювання — частки від одиниці, відсотки. Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається де 0. Адже з кожного мільярда (1 000 000 000) молекул води на йони розгадаються лише дві. Вочевидь такої кількості йонів замало, аби забезпечити бодай трохи помітну електропровідність дистильованої води. Н2 О Н2 О Н+ + ОН- або 2 Н2 О Н3 О + + ОН- Н3 О + - йон гідроксонію. У 1 л води при t = 220 С дисоціює 10 -7 моль води, утворюється 10 -7 моль/л йонів Н+ і 10 -7 моль/л йонів ОН- .[Н+ ] = [ОН-] = 10 -7 моль -> нейтральне середовище;[Н+ ] > 10 -7 моль -> кисле середовище;[Н+ ] < 10 -7 моль -> лужне середовище;Ступінь дисоціації (α) – кількісна характеристика процесу дисоціації: n (число частинок, що розпалися)α = ———————————————————— N (загальне число молекул)Одиниці вимірювання — частки від одиниці, відсотки.](/uploads/files/23931/309156/339885_images/9.jpg)