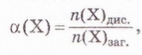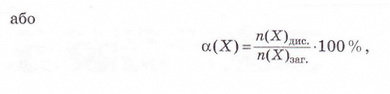Урок на тему "Ступінь дисоціації. Сильні та слабкі електроліти "
Урок №10
Тема: Ступінь дисоціації. Сильні та слабкі електроліти.
Цілі уроку:
дидактичні: дати поняття про ступінь дисоціації та його залежність від природи речовини; розв’язувати прості задачі на визначення ступеня дисоціації.
розвивальні: формувати системність мислення, розвивати вміння працювати з підручником та дидактичним матеріалом, виділяти в головне у прочитаному; розвивати вміння пов’язувати властивості речовин з будовою; розвивати логічне мислення.
виховні: виховувати дисциплінованість і уважність, правильно оцінювати свої можливості, обираючи рівень складності завдання, вміння перевіряти та оцінювати власні знання.
Тип уроку: урок удосконалення набутих знань, комбінований.
Обладнання та матеріали: ПСХЕ; таблиця розчинності кислот, солей, основ; установка для демонстрації електропровідності розчинів; розчини хлоридної та оцтової кислот з однаковою концентрацією; опорна схема « Ступінь дисоціації та сила електроліту».
Базові поняття й терміни: Розчини, розчинник, електроліти, неелектроліти, розчинена речовина, електролітична дисоціація, гідратовані йони, йони гідроксонію, ступінь дисоціації, сильні та слабкі електроліти, електроліти середньої сили.
Хід уроку
І Організація класу
І. Актуалізація опорних знань
Експрес-опитування
- Які речовини називають електролітами?
- Які речовини називають неелектролітами?
- Дати визначення кислот з точки зору електролітичної дисоціації.
- Дати визначення основ з точки зору електролітичної дисоціації.
- Дати визначення солей з точки зору електролітичної дисоціації.
ІІ. Мотивація проблемно-пізнавальної діяльності
(Створення проблемної ситуації)
Порівняйте електропровідність розчинів хлоридної та оцтової кислот однакової концентрації – розчин HCl дає більш яскраве світло.
- Чим можна пояснити електропровідність даних розчинів?
-Чим можна пояснити різну яскравість розглянутих розчинів?
Учні мають зробити висновок, що в розчині хлоридної кислоти йонів більше.
HCl ↔ H+ + Cl-;
CH3 COOH ↔ CH3COO- + H+
Але написання рівнянь реакцій дисоціації спростовує цю думку, отже виникає проблема.
ІІІ. Вивчення нового матеріалу
Не всі електроліти однаково дисоціюють на йони. Поряд з процесом дисоціації відбувається і зворотній процес – асоціація (з’єднання йонів). Тому в розчинах електролітів разом з йонами містяться і молекули.
|
Для сильних електролітів йонної будови (солей, лугів) процес дисоціації є необоротнім, у їхніх розчинах містяться лише гідратовані йони. NaNO3 = Na++ NO3- KOH = K+ + OH- |
Для слабких електролітів і електролітів молекулярної будови процес дисоціації є оборотним. H2S ↔ 2H+ + S2- HNO3 ↔ H+ +NO3- |
Кількісно процес дисоціації характеризується ступенем дисоціації (α- альфа), який є відношенням числа частинок n, що розпалися на йони, до загального числа частинок N розчиненої речовини:
n (число частинок, що розпалися)
α = ————————————————————
N (загальне число частинок, внесених у розчин)
Ступінь дисоціації виражають у частках одиниці або у відсотках. Якщо α = 0, то дисоціації немає, а якщо α = 1 або 100%, то електроліт повністю розщеплюється на йони.
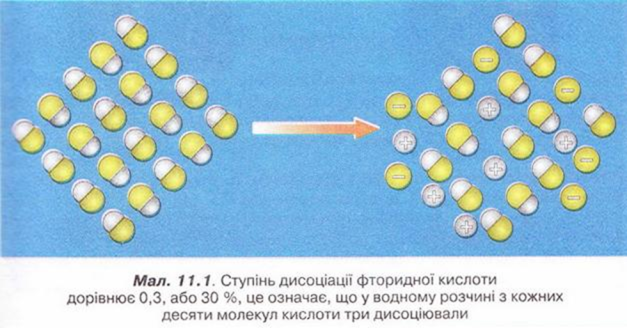
Наприклад, якщо ступінь дисоціації фторидної кислоти дорівнює 30 %, або 0,3, це означає, що у водному розчині з кожних ста молекул кислоти тридцять розпалися на йони. Або з кожних десяти молекул кислоти три дисоціювали (мал. 11.1):
α (НF) = 0,3(30 %)
Ступінь дисоціації електролітів визначається експериментально. Він залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо. Чим більша полярність розчинника, тим більший ступінь дисоціації електроліту в ньому. Підвищення температури, як правило, збільшує дисоціацію, тож за нагрівання ступінь дисоціації зростає. У разі зменшення частки електроліту у розчині, тобто під час його розбавляння, ступінь дисоціації збільшується. Тож, зазначаючи ступінь дисоціації, слід зазначати й концентрацію розчину.
Речовини, ступінь дисоціації яких високий (α ≈ 1), називаються сильними електролітами, а речовини, ступінь дисоціації яких низький – слабкими електролітами. До сильних електролітів належать речовини йонної будови:кислоти , луги та чи не всі солі.
Серед кислот є як сильні, так і слабкі електроліти.

Запитання
Від чого залежать сили кислот?
Назвати приклади сильних і слабких електролітів.
Робота з підручником (самостійне опрацювання).
Висновки учнів – сила електроліту залежить від полярності хімічного зв’язку: чим зв’язок полярніший, тим легше він розривається і тим електроліт сильніший.
Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається де 0. Адже з кожного мільярда (1 000 000 000) молекул води на йони розгадаються лише дві. Вочевидь такої кількості йонів замало, аби забезпечити бодай трохи помітну електропровідність дистильованої води.
Н2О ![]() Н+ + ОН- або 2Н2О
Н+ + ОН- або 2Н2О ![]() Н3О + + ОН-
Н3О + + ОН-
Н3О + - йон гідроксонію.
У 1 л води при ![]() = 220С дисоціює 10 -7 моль води, утворюється 10 -7 моль/л йонів Н+ і 10 -7 моль/л йонів ОН- .
= 220С дисоціює 10 -7 моль води, утворюється 10 -7 моль/л йонів Н+ і 10 -7 моль/л йонів ОН- .
[Н+ ] = [ОН-] = 10 -7 моль -> нейтральне середовище;
[Н+ ] > 10 -7 моль -> кисле середовище;
[Н+ ] < 10 -7 моль -> лужне середовище;
Ступінь дисоціації (α) – кількісна характеристика процесу дисоціації:
n (число частинок, що розпалися)
α = ————————————————————
N (загальне число молекул)
Одиниці вимірювання — частки від одиниці, відсотки.

![]()
 Електроліти
Електроліти
Сильні Середньої Слабкі
(α=1) сили (α <<1)
А) Майже всі солі; H2SO4, А) Майже всі органічні
Б) луги; H3PO4, кислоти
В) кислоти: H2SO4, Hl, Б) основи(окрім лугів)
HNO3, HBr, HCl, HClO4, В) деякі кислоти: HClO,
HMnO4 H2S, HNO2, H2СO3,
H2SiO3, HСN.
Сильні кислоти – HClO4 = HNO3 = HCl = H2SO4>
Середні кислоти – H2SO3 >H3PO4>HF > HNO2>
Слабкі кислоти – CH3COOH > H2CO3>H2S >H2SiO3.
ІV. Творче застосування отриманих знань
( керована практика)
Самостійна робота
Завдання 1. Обчисліть ступінь дисоціації речовин, якщо:
Варіант 1
а) з кожних 200 молекул продисоціювали 5;
б) з кожних 60 молекул продисоціювали 40;
Варіант 2
а) з кожних 300 молекул продисоціювали 15;
б) з кожних 80 молекул продисоціювали 50;
Завдання 2. До якої групи електролітів можна віднести їх за ступенем дисоціації?
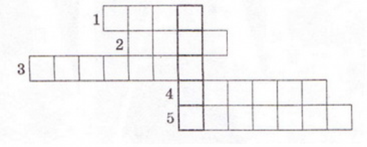
Завдання 3. Розв'яжіть кросворд, ключове слово якого по вертикалі - назва літери - позначення ступеня дисоціації.
По горизонталі:
1. Найпоширеніший дуже слабкий електроліт.(вода)
2. Клас неорганічних сполук, здебільшого сильні електроліти.(солі)
3. Кількісна характеристика дисоціації електролітів.(ступінь)
4. Кислотний залишок слабкої галогеноводневої кислоти.( фторид )
5. Слабка кислота із жарознижувальним ефектом. (аспірин)
V. Підсумки уроку
Стисло про головне
Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули.
Ступінь електролітичної дисоціації - це відношення числа молекул (формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини.
Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляють «альфа»). Її виражають у частках одиниці або у відсотках:
де n(X) дис. - кількість формульних одиниць електроліту, які розпалися на йони, а п(Х)заг. - загальна кількість формульних одиниць електроліту.
Ступінь дисоціації електролітів залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо.
Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими.
Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. Силу кислот визначають за ступенем електролітичної дисоціації.
Карбонатна, сульфітна, сульфідна, силікатна, молочна, оцтова, аскорбінова (вітамін С) й ацетилсаліцилова (аспірин) кислоти, гідроксиди металічних елементів (за винятком лугів) - слабкі електроліти. Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 % .
Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається до 0.
Оцінювання
VІ. Домашнє завдання
§ 8 ст.43-46; Вправи 6,7 ст.73(сильним), 4.5 ст.73 (слабшим).
- Чим більший ступінь електролітичної дисоціації речовин, тим вона:
а) сильний електроліт; б)слабкіший електроліт.
2. При підвищенні концентрації електроліту ступінь дисоціації:
а) збільшується; б) зменшується; в) не змінюються.
Завдання для допитливих. Для приготування маринадів використовують столовий оцет (6-9%) чи оцтову есенцію (37%). Чи різниться ступінь дисоціації в першому і другому випадках? Чи однаково проводитимуть електричний струм ці розчини? Який із них найчастіше використовують при консервуванні? Як ти гадаєш, чому? Обґрунтуй свої висновки відповідними розрахунками.


про публікацію авторської розробки
Додати розробку