Презентація на тему: "Солі амонію"
Про матеріал
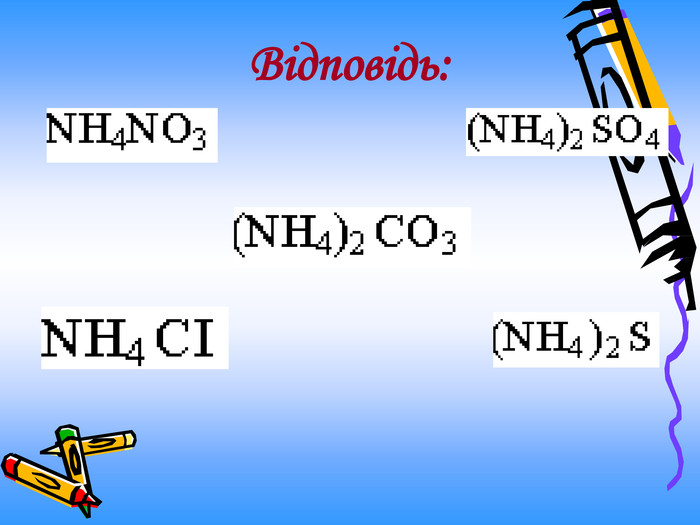
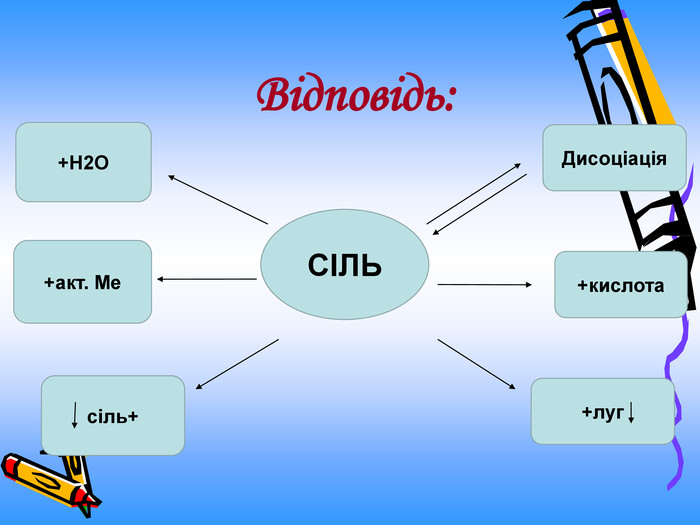
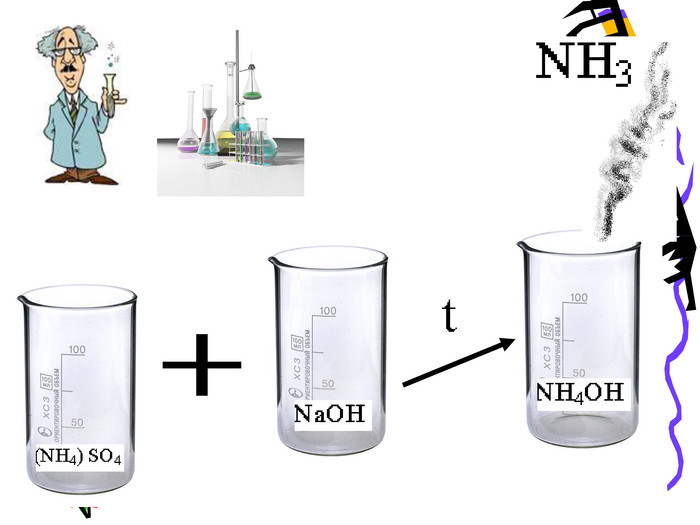
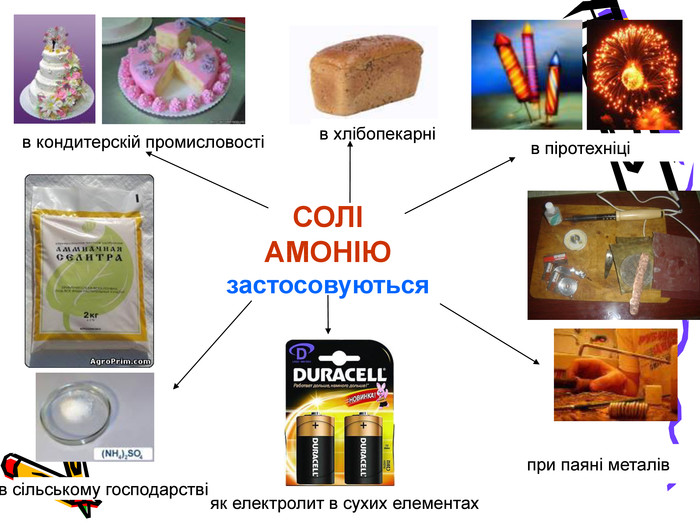
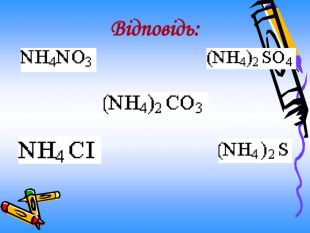
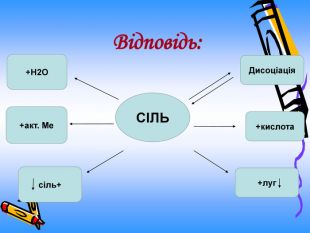
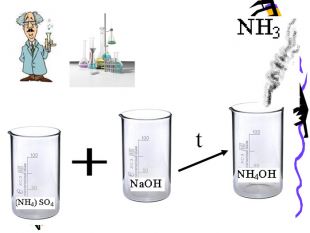
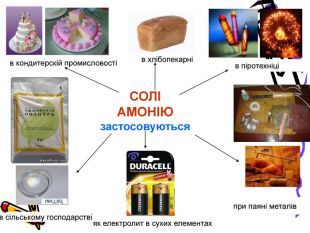
Актуальність презентації починається з ланцюжка - задач уроку. Ліцеїсти вивчають склад солей, фізичні, хімічні (за допомогою хімічного експерименту) та добування і застосування солей. Презентація дає змогу самостійно виконувати завдання і порівнювати відповіді, яскраво представляючи застосування солей амонію. Презентація починається і закінчується ланцюжком.
Перегляд файлу
Зміст слайдів
ppt
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку