Презентація "Ненасичені вуглеводні"
Про матеріал
Презентація до уроку хімії в 10 класі на тему "Ненасичені вуглеводні". Презентація містить експрес-тест для актуалізації опорних знань, основний та додатковий матеріал з теми, історичні відомості, міжпредметні зв'язки, цікаві факти, завдання для закріплення, домашнє завдання, задачі для самостійного розв'язання.
Перегляд файлу





















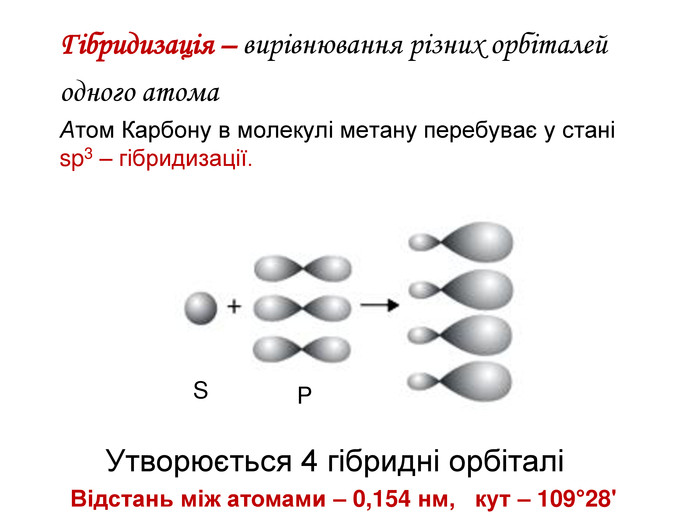
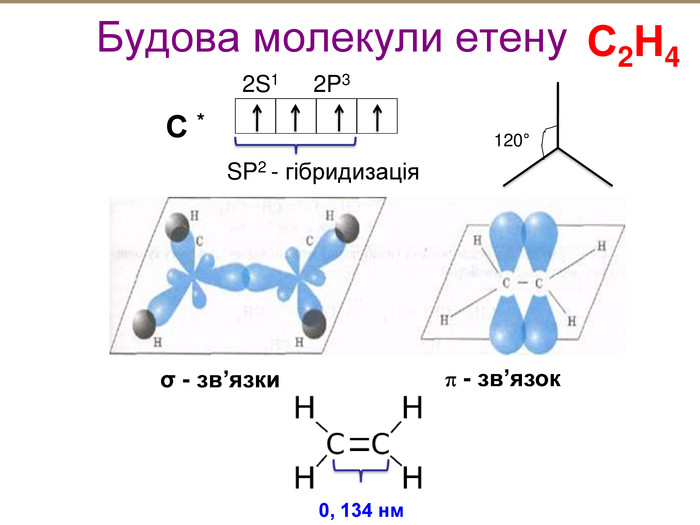
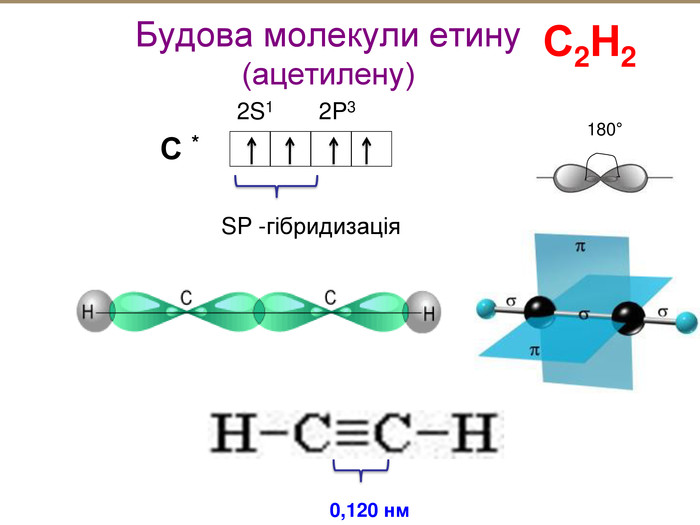
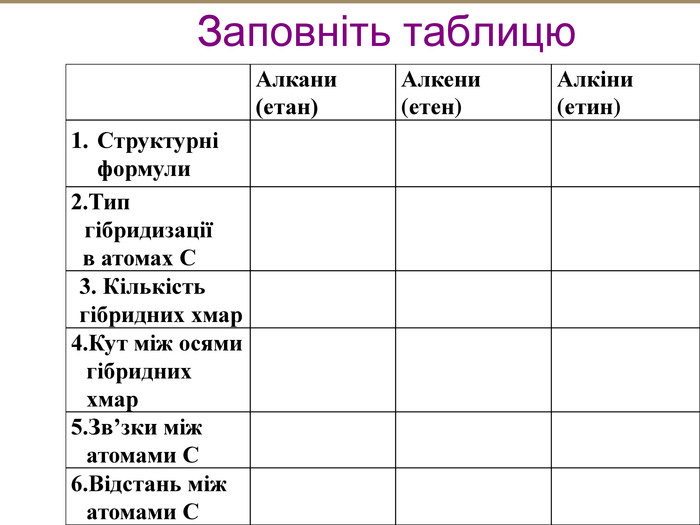








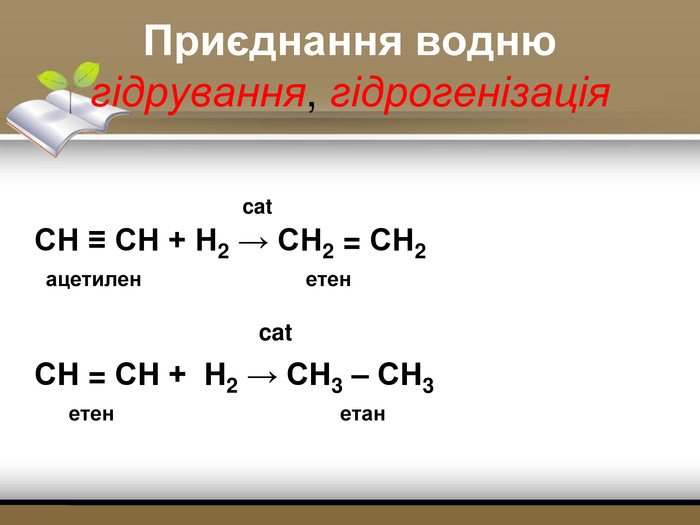



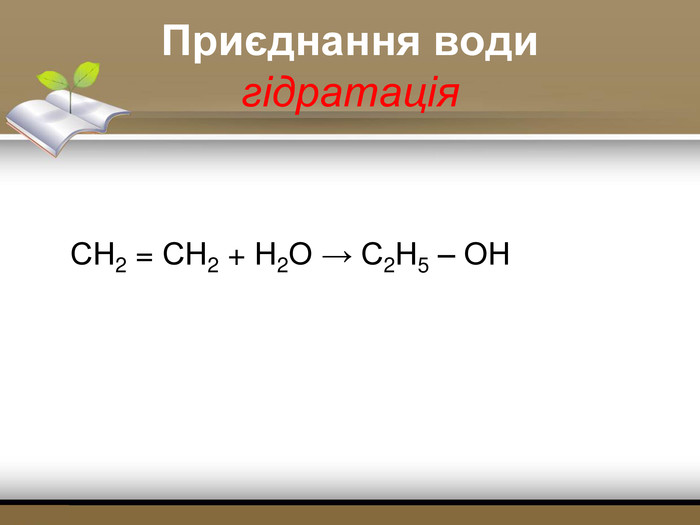



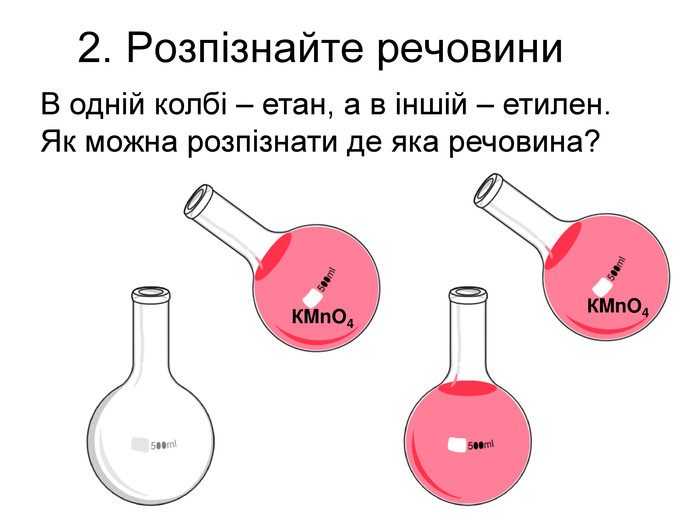


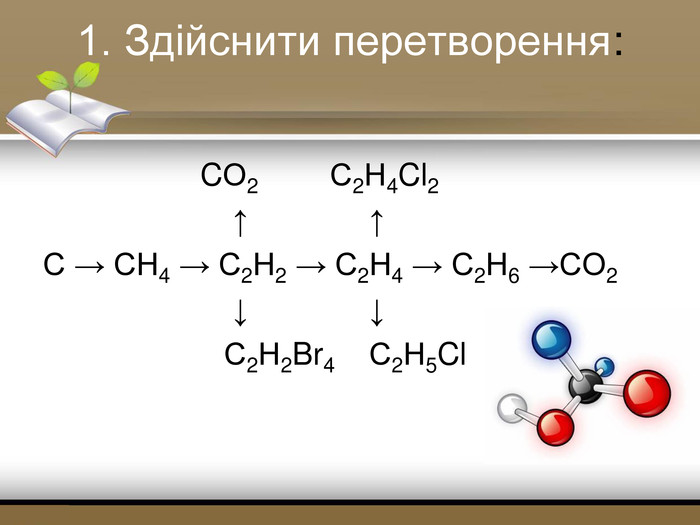

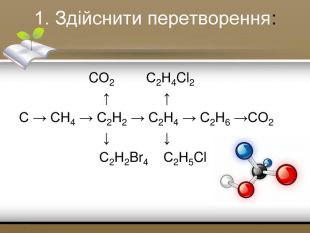
Зміст слайдів
Середня оцінка розробки
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Загальна:
5.0
Всього відгуків: 8
Оцінки та відгуки
pptx
Додано
15 липня 2018
Переглядів
12736
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
Рекомендовані матеріали
Схожі матеріали





















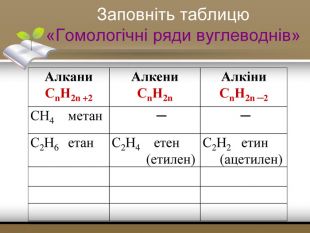
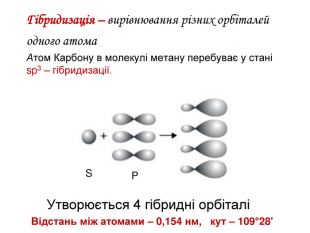
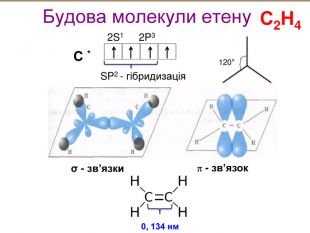
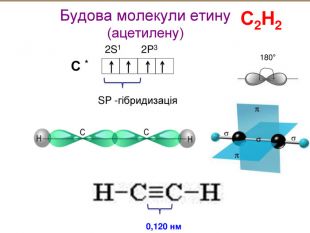
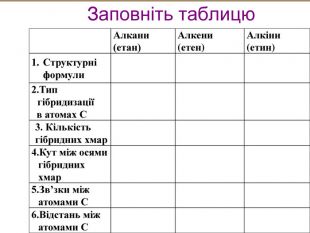






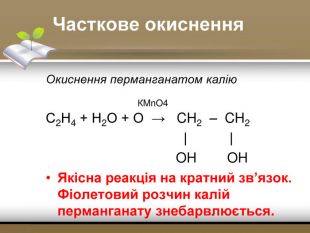

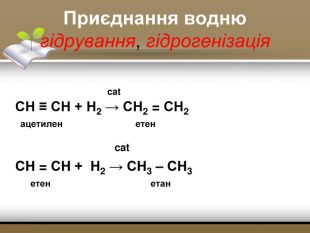







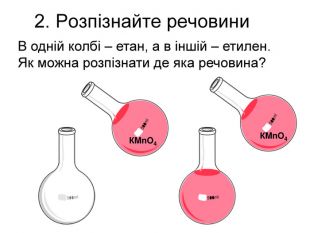



-

Волошина Олена Іванівна
30.09.2024 в 15:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Смакоуз Тамара Василівна
05.11.2022 в 17:06
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сердюк Ольга
02.02.2022 в 20:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

марченко оксана
08.02.2021 в 20:42
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

марченко оксана
08.02.2021 в 20:42
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Акульшина Елена
22.09.2020 в 20:40
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рибак Олена Миколаївна
17.02.2020 в 20:08
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Муратова Світлана
01.11.2019 в 21:51
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків