презентація "Основні групи хімічних елементів"
В презентації подано унаочнено матеріал про основні групи хімічних елементів в періодичній таблиці Д.І. Менделеева: лужні метали, лужноземельні метали, галогени та інертні гази. Вказано і специфіку елементів цих груп та сфери використання деяких елементів - як додатковий розвивальний елемент отриманих знань та направленність знань на повсякденне використання.



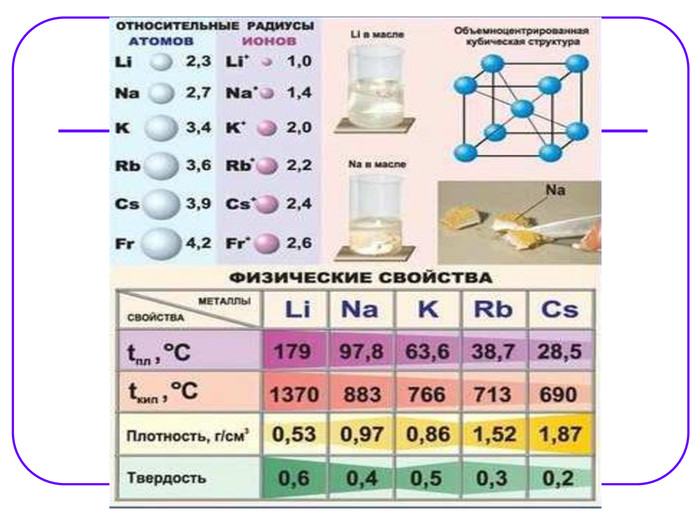
![Li Na K Rb Cs Fr 7 23 39 85 133 [233] )) ))) )))) ))))) )))))) ))))))) З Б І Л Ь Ш У Ю Т Ь С Я З Б І Л Ь Ш У Ю Т Ь С Я Елемент Ar валентні атомний металічні відновні електрони радіус властивості властивості Li Na K Rb Cs Fr 7 23 39 85 133 [233] )) ))) )))) ))))) )))))) ))))))) З Б І Л Ь Ш У Ю Т Ь С Я З Б І Л Ь Ш У Ю Т Ь С Я Елемент Ar валентні атомний металічні відновні електрони радіус властивості властивості](/uploads/files/23962/32757/32841_images/4.jpg)































Хлор был открыт шведским химиком Карлом Шееле в 1774 г. 35,453 17 Газ желто-зеленого цвета с резким запахом, ядовит в 2,5 раза тяжелее воздуха в 1 объеме воды при 20 °С растворяется около 2 объемов хлора в 1810 году сэр Гемфри Дэви назвал газ "хлорином"(Chlorine), от греческого "зелёный". Этот термин используется в английском языке, а в других языках закрепилось название "хлор".
от греч. iodes—имеющий фиалковый цвет в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары -фиолетового цвета 126,9 53 Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент Известны 37 изотопов иода с массовыми числами от 108 до 144.
от греч. bromos – зловоние единственный неметалл, жидкий при комнатной температуре 79,9 35 79Вr (50,56%) 81Вr (49,44%) пары брома имеют желто-бурый цвет при температуре –7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском тяжелая красно-бурая жидкость с неприятным запахом
Бром находится в крови, мозге, печени, почках. Больше всего его в мозге. В гипофизе (мозговом придатке) брома в 2 5—50 раз больше, чем в крови, в 15—20 раз больше, чем в печени. По поводу роли брома как микроэлемента существуют некоторые сомнения, хотя достоверно известно его седативное действие. В человеческом теле средняя концентрация брома составляет около 3,7 мг/кг. Бром от греческого бромос означает зловонный
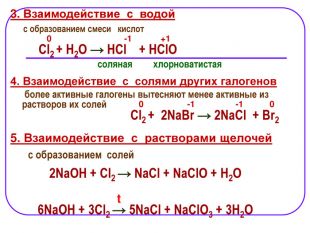
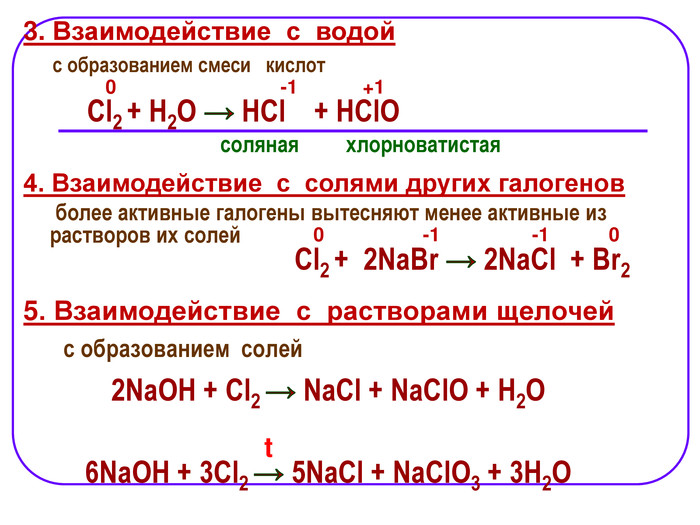
1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): 2. Взаимодействие с неметаллами C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды. -1 -1 -1 -1
- 5 % спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения - В рентгенологических и томографических исследованиях применяются йодсодержащие контрастные препараты - Галоге́нная ла́мпа — лампа накаливания, в баллон которой добавлены пары галогенов (брома или йода) - Лазерный термоядерный синтез - иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах В технике В медицине
Применение йода для получения высокочистого титана (Ti), циркония (Zr), гафния (Hf), ниобия (Nb) и других металлов (так называемое иодидное рафинирование металлов); в иодных лампах накаливания, имеющих вольфрамовую спираль и характеризующихся большим сроком службы; применяют в пищевых добавках; в фотоделе; в аналитической химии - иодометрии; в медицине в качестве антисептического и кровеостанавливающего средства, однако обрабатывать иодной настойкой можно только небольшие раны, так как иод может вызвать омертвение ткани, что при больших ранах увеличит сроки их заживления.
Применение фтора Фтор широко применяют при получении различных фторидов; в производстве тефлона (антипригарное покрытие), других фторопластов, фторкаучуков; фторсодержащих органических веществ и материалов, которые широко применяют в технике, особенно в тех случаях, когда требуется устойчивость к агрессивным средам, высокой температуре и т. п.; В качестве фреонов и хладонов - в холодильных и морозильных установках, в аэрозольных баллонах; в производстве зубной пасты
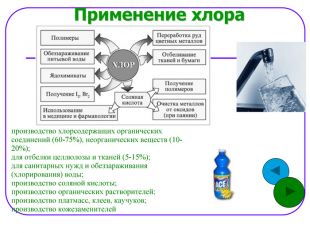
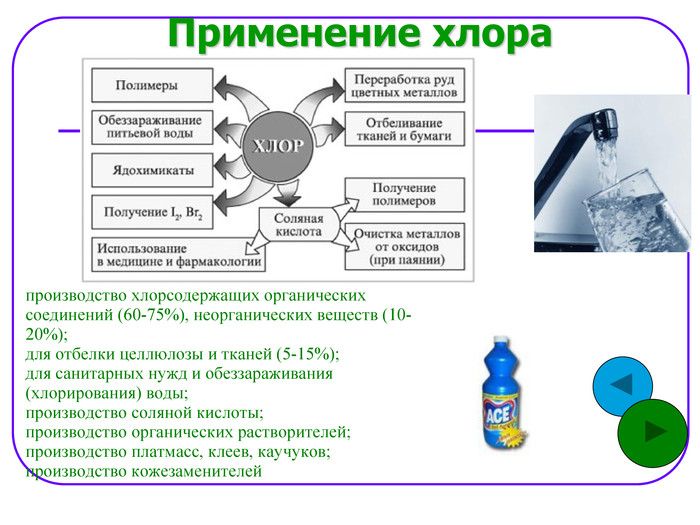
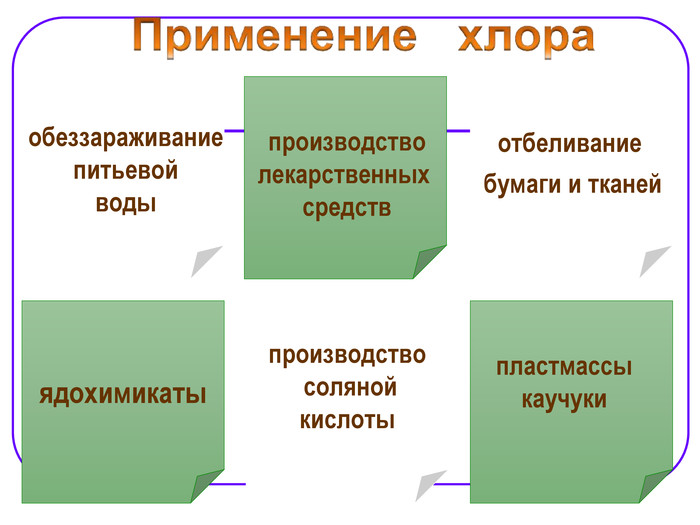
Применение хлора производство хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%); для отбелки целлюлозы и тканей (5-15%); для санитарных нужд и обеззараживания (хлорирования) воды; производство соляной кислоты; производство органических растворителей; производство платмасс, клеев, каучуков; производство кожезаменителей
Применение брома для получения ряда неорганических и органических веществ; соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения; в фотоделе (AgBr) как светочувствительный материал; в медицине в качестве успокоительного средства. Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе.
Содержание йода в виде различных соединений в организме человека составляет 25—30 мг. Из этого количества 15 мг находится в щитовидной железе. Йод участвует в метаболизме щитовидной железы и присущих ей гормонах. В настоящее время считают, что ведущую роль йод играет только в деятельности щитовидной железы. Недостаток йода приводит к слабости, пожелтению кожи, возникновению ощущения холода и сухости. Особенно сильно это отражается на здоровье детей – они отстают в физическом и умственном развитии. Йод от греческого иодэс означает фиолетовый
-
 Саніна Наталія Валеріївна 02.10.2019 в 09:15Загальна:4.7Структурованість5.0Оригінальність викладу5.0Відповідність темі4.0
Саніна Наталія Валеріївна 02.10.2019 в 09:15Загальна:4.7Структурованість5.0Оригінальність викладу5.0Відповідність темі4.0


про публікацію авторської розробки
Додати розробку