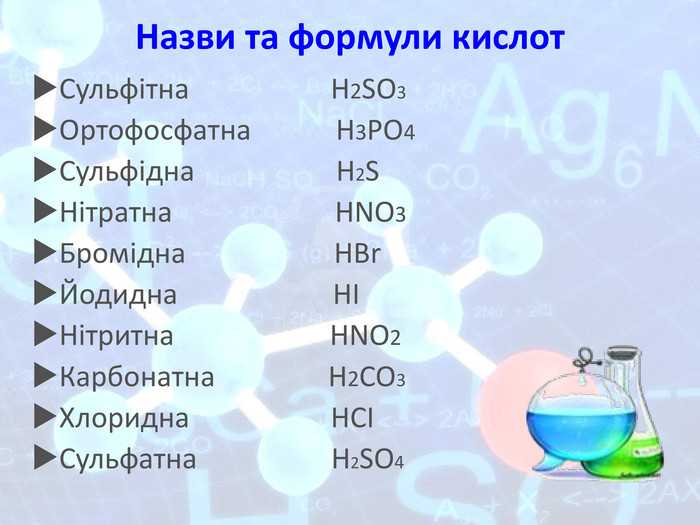
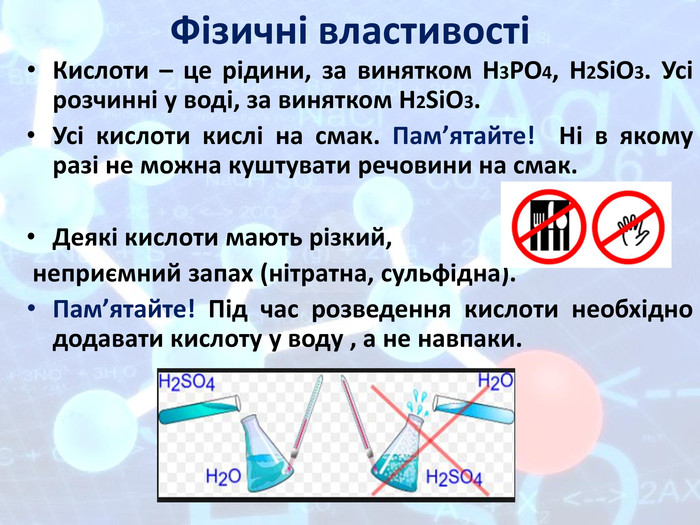
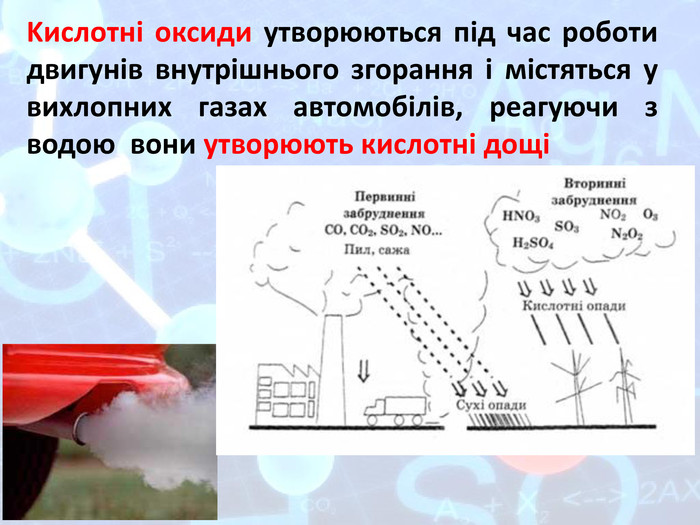
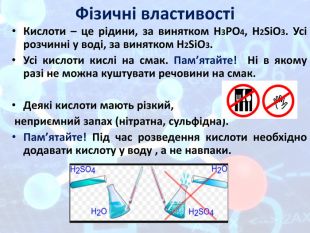
Презентація "Подорож по кислотній країні"
Про матеріал
Даний матеріал укладений відповідно до програми й можна використати у формі дистанційної роботи. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку