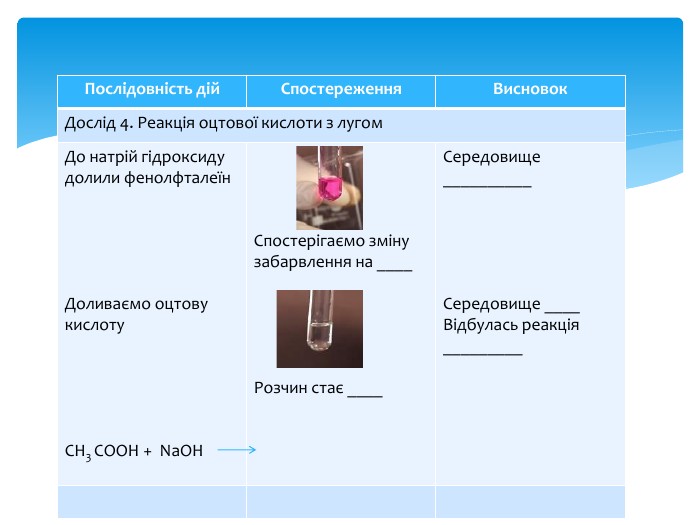
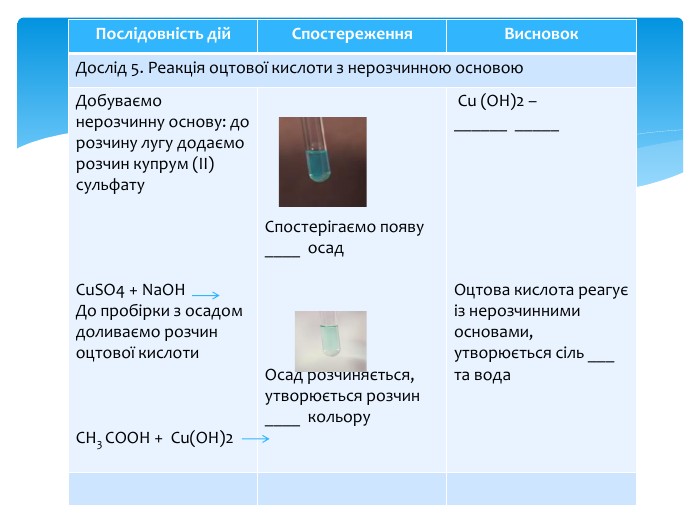
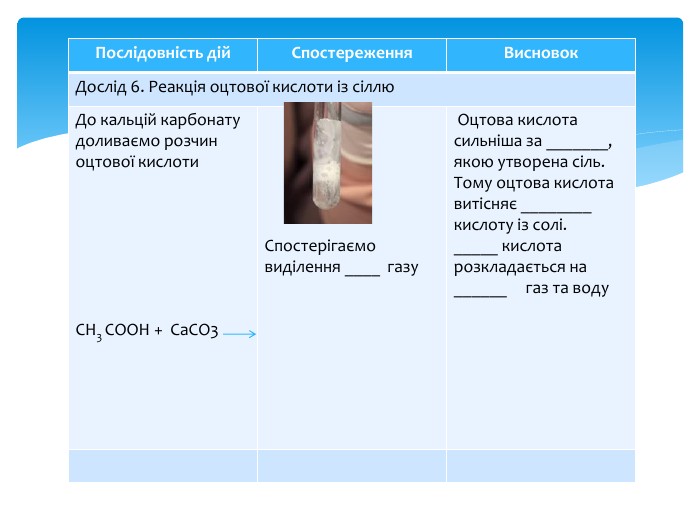
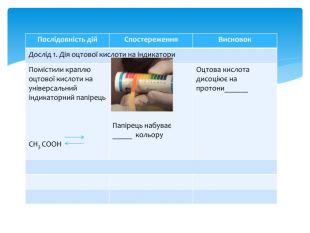
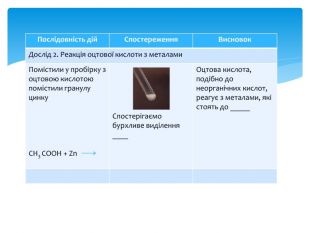
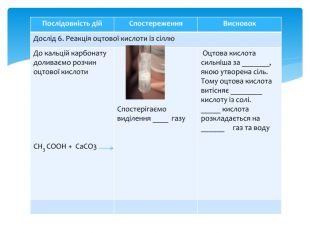
Презентація Практична робота 1 "Властивості етанової кислоти"
Про матеріал
Презентація до практичної роботи буде доречною під час дистанційного навчання. Матеріал відповідає чинній програмі Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку