Презентація «Розчини кислот, лугів та солей у воді» 9 клас
Про матеріал
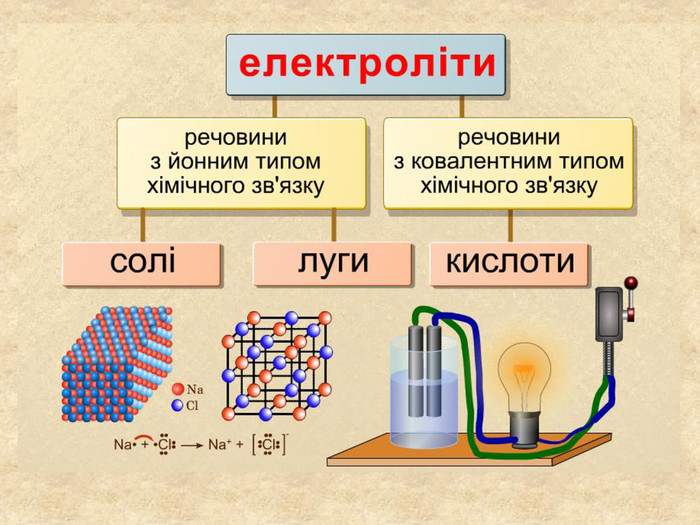
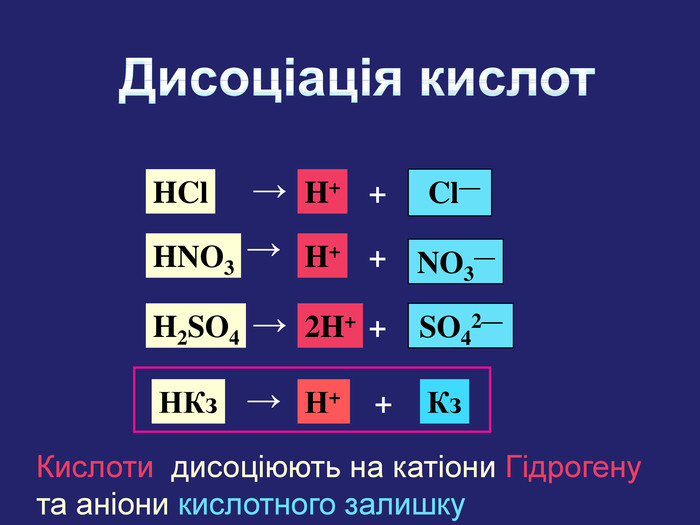
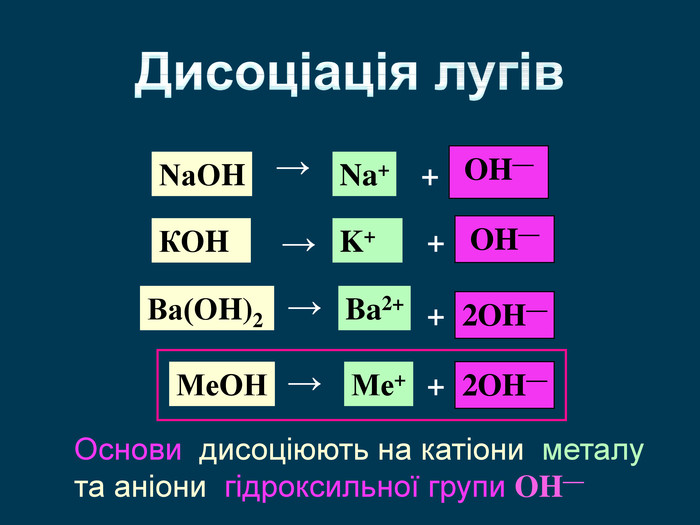
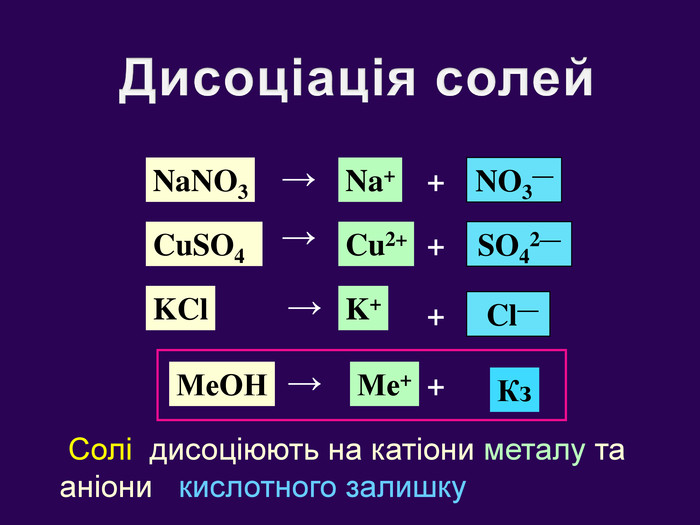
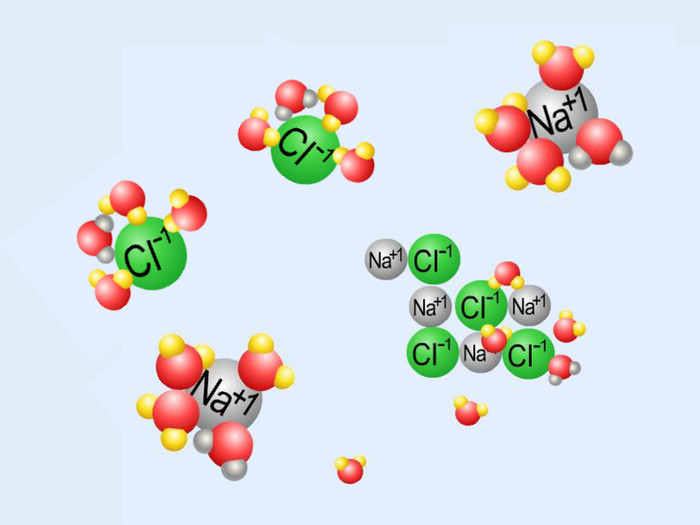
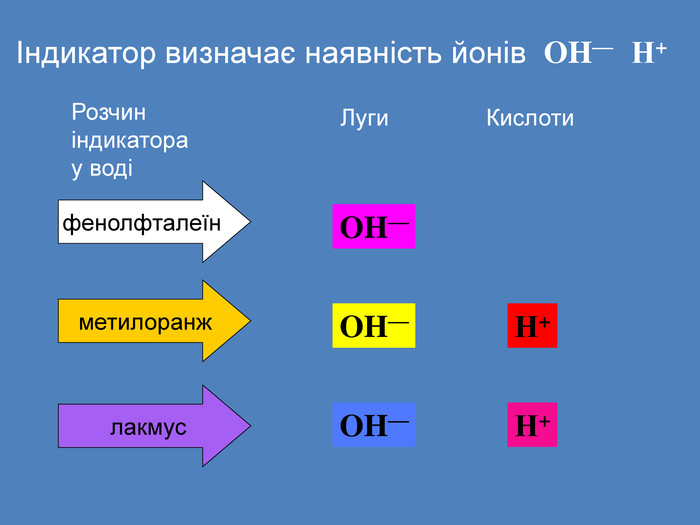
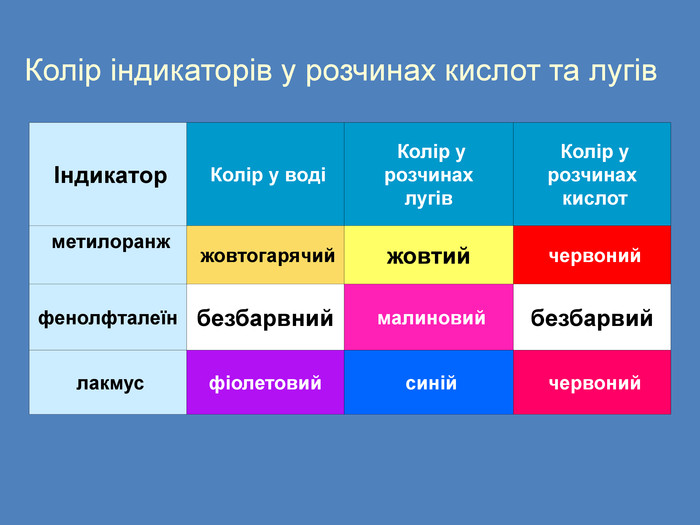
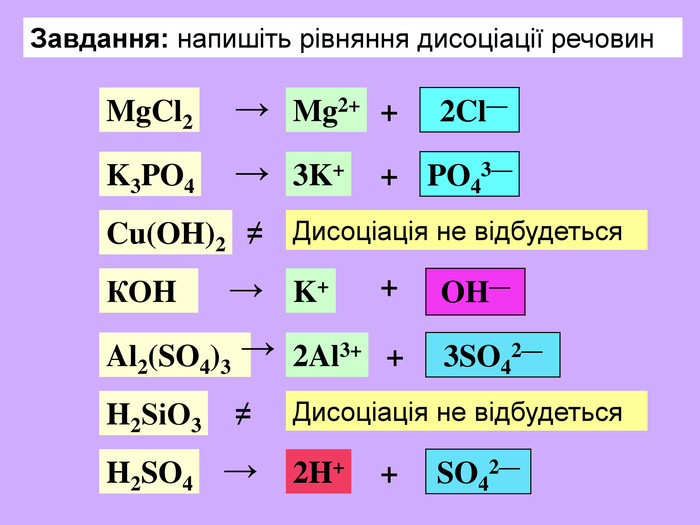
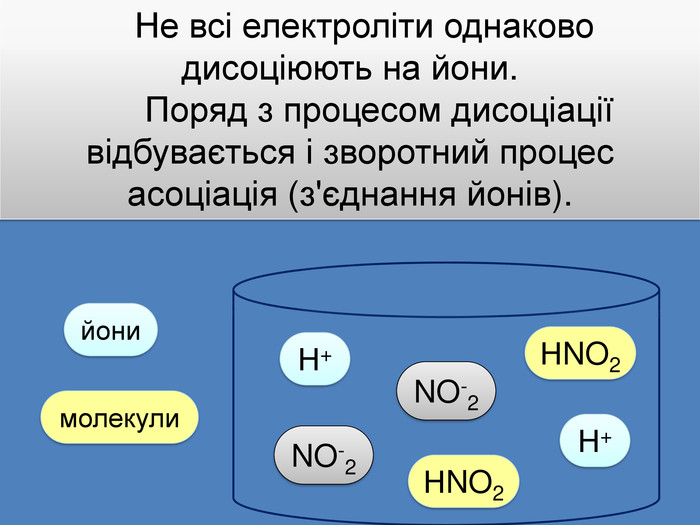
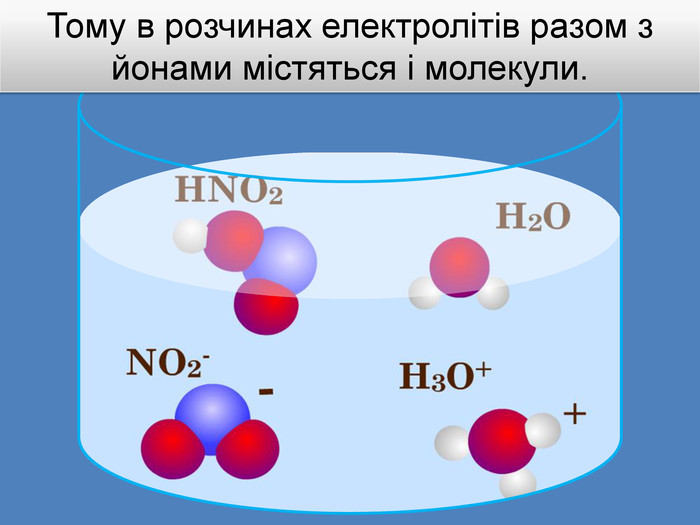
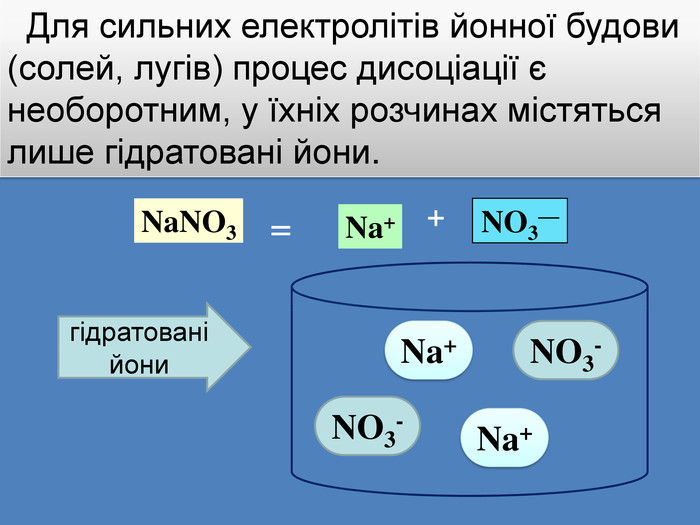
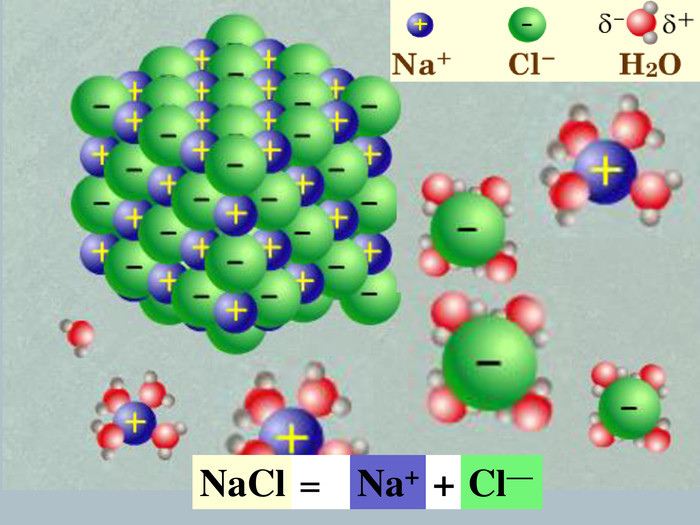
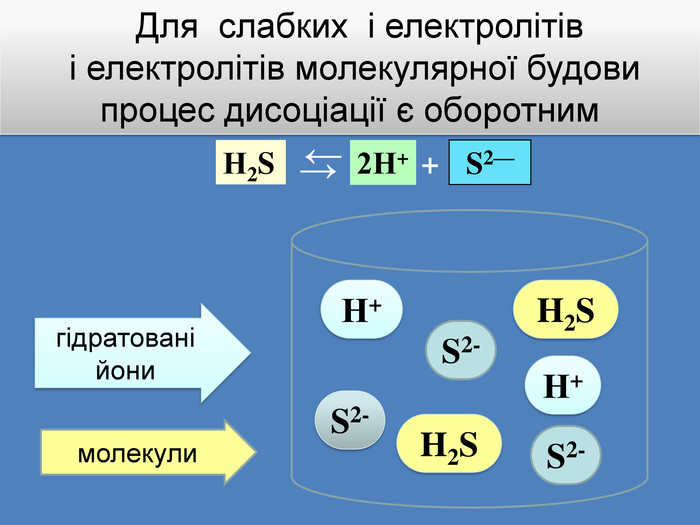
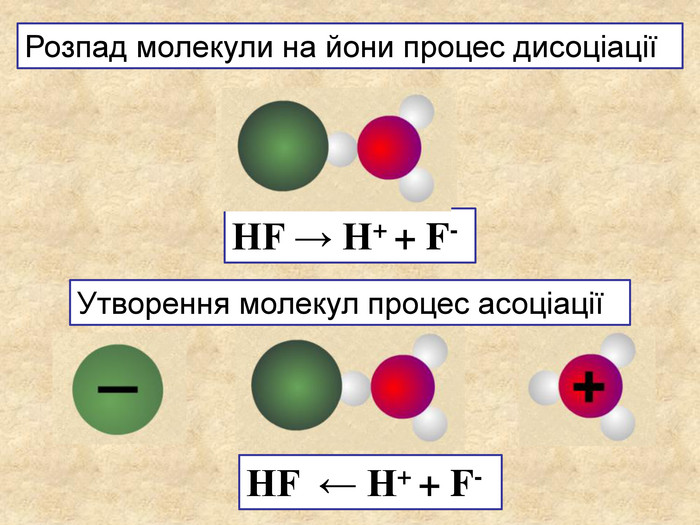
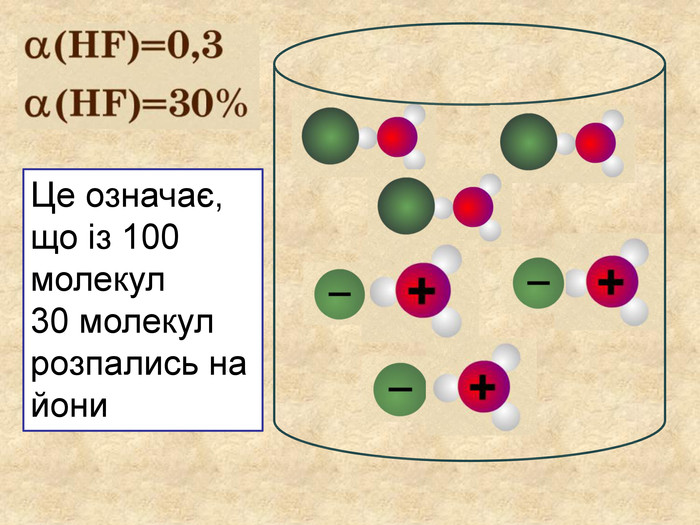
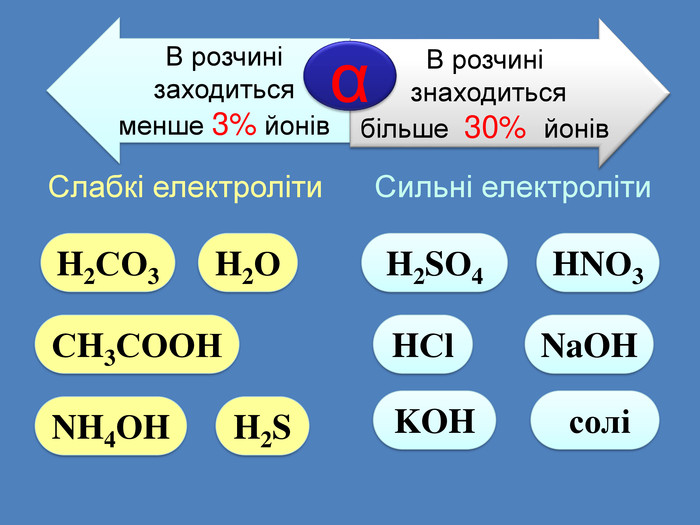
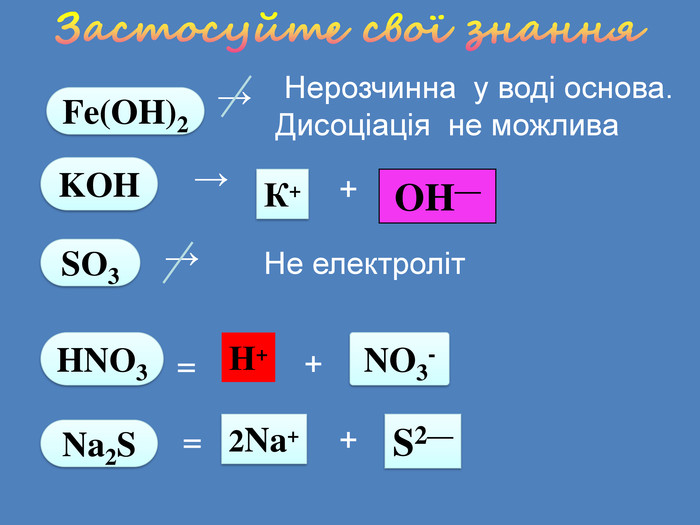
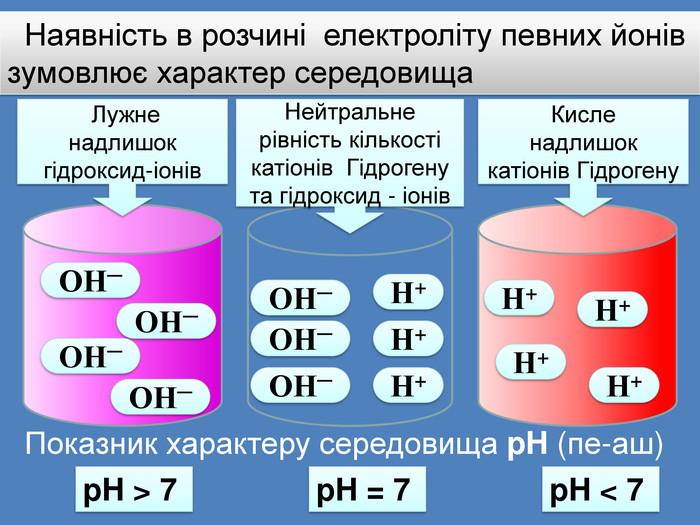
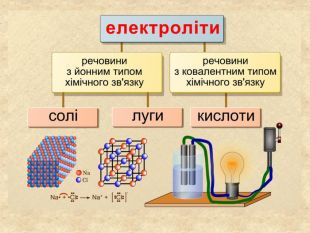
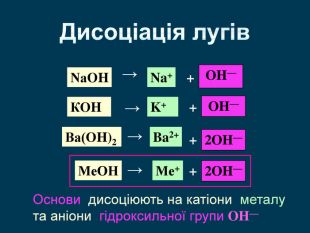
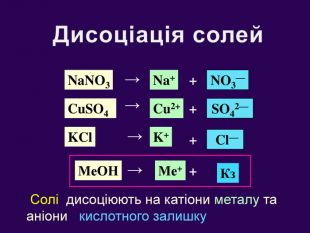
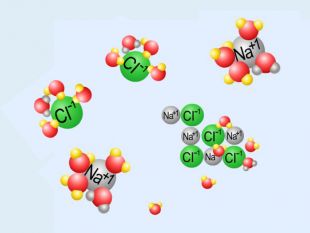
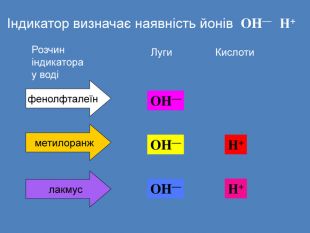
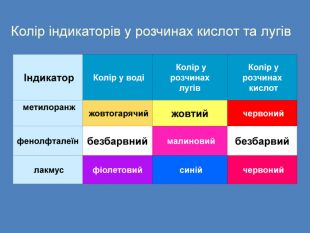
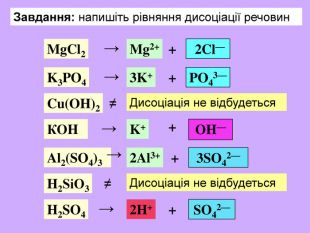
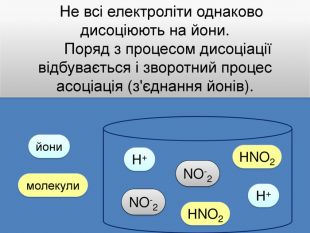
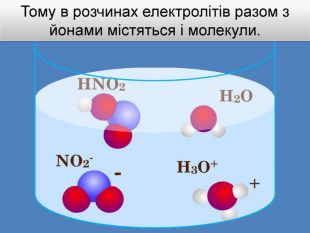
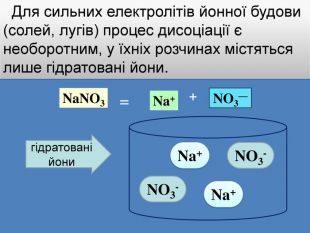
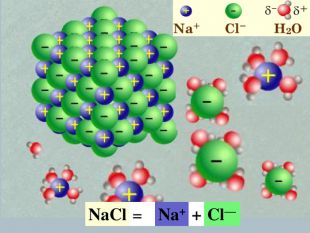
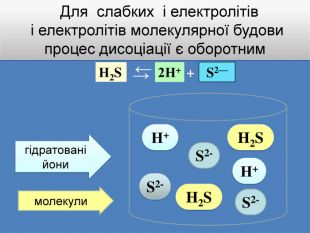
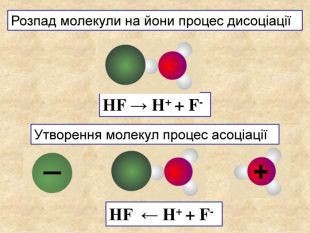
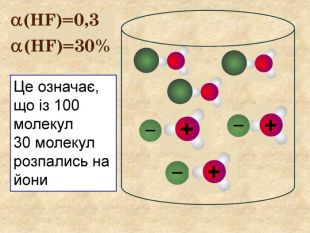
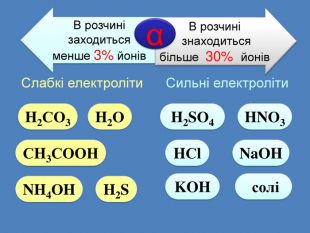
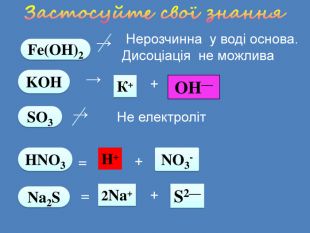
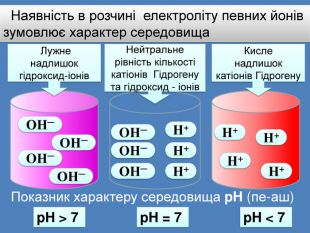
| Презентація допоможе учням та вчителю при проведенні уроку на тему «Електролітична дисоціація кислот, основ, солей у водних розчинах». Та глибше розтлумачити складні поняття «Ступінь електролітичної дисоціації». «Сильні й слабкі електроліти». |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




























-

Теребіленко Людмила Володимирівна
10.10.2024 в 17:30
Дякую, Ви - неймовірний!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гурєєва Ольга В'ячеславівна
22.10.2023 в 18:03
Чудовий урок, неймовірні анімації. Відчувається відданість професії та високий професіоналізм. Дякую за Вашу працю! Як би можна було поставити 12 балів, то зробила б саме так!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рабієвська Любов Анатоліївна
11.10.2022 в 09:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тодоров Леонід
05.10.2021 в 19:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рябченко Віталік
08.10.2020 в 20:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Власенко Оксана Миколаївна
06.10.2020 в 21:45
Загальна:
4.0
Структурованість
4.0
Оригінальність викладу
3.0
Відповідність темі
5.0
Показати ще 3 відгука