Презентація "Розчинність речовин, її залежність від різних чинників."
Про матеріал
Презентація розроблена за навчальною програмою для загальноосвітніх навчальних закладів (зі змінами, затвердженими наказом МОН України від 29.05.2015 № 585) Матервал допоможе учителям ознайомити учнів з факторами, що впливають на розчинність і швидкість розчинення речовин в воді, ознайомити учнів із класифікацією розчинів і встановити різницю між насиченим і ненасиченим розчином, розбавленим і концентрованим розчином, розвинути уміння пов’язувати знання, здобуті раніше на уроках хімії та інших предметів, з новою темою, розвинути в учнів логічне мислення, показати учням значення розчинів у природі й життєдіяльності людини, виховати дбайливе ставлення до природи Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
До підручника
Хімія 9 клас (Гранкіна Т.М.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку












![Список використаних джерел Література: Попель П.П. Хімія: підруч. для 9 кл. загальноосвіт. навч. закл. / П.П.Попель, Л.С.Крикля – К.: ВЦ «Академія», 2009 – 232 с.: іл. (книга двох авторів). Дігавцова Л.Ю. Хімія. 9 клас : Плани-конспекти уроків на друкованій основі / Л. Ю. Дігавцова — Х. : Вид-во «Ранок», 2013. — 128 с. — (Серія «Конструктор уроку»). (книга одного автора). Старовойтова І.Ю. Усі уроки хімії 9 клас / І.Ю.Старовойтова, О.В.Люсай. – Х.: Вид. Група «Основа», 2009 – 239, [1]с.: іл.,табл. – (Серія « 12 – річна школа»). (книга одного автора). Список використаних джерел Література: Попель П.П. Хімія: підруч. для 9 кл. загальноосвіт. навч. закл. / П.П.Попель, Л.С.Крикля – К.: ВЦ «Академія», 2009 – 232 с.: іл. (книга двох авторів). Дігавцова Л.Ю. Хімія. 9 клас : Плани-конспекти уроків на друкованій основі / Л. Ю. Дігавцова — Х. : Вид-во «Ранок», 2013. — 128 с. — (Серія «Конструктор уроку»). (книга одного автора). Старовойтова І.Ю. Усі уроки хімії 9 клас / І.Ю.Старовойтова, О.В.Люсай. – Х.: Вид. Група «Основа», 2009 – 239, [1]с.: іл.,табл. – (Серія « 12 – річна школа»). (книга одного автора).](/uploads/files/893284/227971/243983_images/19.jpg)




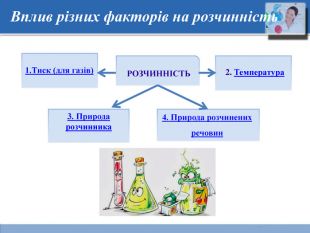

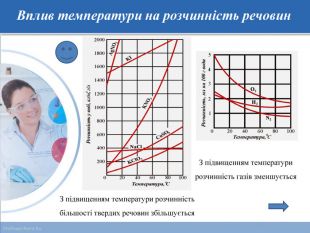
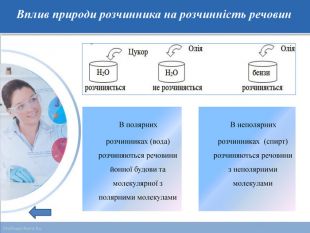




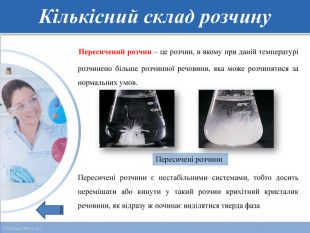




-

Школьник Олександр Григорович
21.09.2023 в 10:12
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
28.09.2022 в 20:30
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

іщенко лариса
27.09.2022 в 17:39
завдяки малюнкам все дуже зрозуміло для учня, дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Димарєва Лілія
20.09.2022 в 20:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Осіпчук Валентина
17.09.2022 в 09:09
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука