Урок "Теплові явища, що супроводжують розчинення речовин."
ТЕМА УРОКУ: Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати.
МЕТА УРОКУ: ознайомити учнів фізико-хімічною природою процесу "розчинення; з'ясувати внутрішню сутність процесу розчинення; показати, що процес розчинення супроводжується не лише фізичними явищами, але й хімічною взаємодією розчинника й розчиненої речовини; дати уявлення про теплові явища, що супроводжують процес розчинення; сформувати поняття про кристалогідрати
ХІД УРОКУ
І. Організація класу.
Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів.
ІІ. Мотивація уроку.
ІІІ. Повідомлення теми, мети уроку.
IV. Актуалізація знань.
Бесіда.
- Які суміші називають розчинами?
- 3 яких компонентів складаються розчини?
- Які розчини називають насиченими, ненасиченими, розбавленими, концентрованими?
- Чи може розбавлений розчин бути насиченим?
- Чи обов'язково концентрований розчин буде насиченим? Тести
V. Вивчення нового матеріалу.
Проблемні питання.
1. При утворенні хімічного зв'язку енергія поглинається чи виділяється?
2. При руйнуванні хімічного зв'язку енергія поглинається чи виділяється?
1. ТЕПЛОВІ ЕФЕКТИ РОЗЧИНЕННЯ
При розчиненні відбуваються два процеси. Перший - руйнування хімічних зв'язків у кристалічних решітках; при цьому енергія поглинається. Другий - утворення міжмолекулярних зв'язків при гідратації; при цьому енергія виділяється. Загальний тепловий ефект розчинення дорівнює сумі двох теплових ефектів названих процесів: якщо при гідратації виділяється енергії більше, ніж витрачається на руйнування кристалічних решіток, то при розчиненні енергія виділяється і розчин нагрівається і навпаки.
Q розчинення = Q гідратації — Qкрист. решітки
якщо Q гідратації < Qкрист. решітки, то Q розчинення< 0 (теплота поглинається)
якщо Q гідратації> Qкрист. решітки, то Q розчинення > 0 (теплота виділяється)
Бесіда.
- Яким процесом (фізичним чи хімічним) є розчинення?
- Чому розчинення є фізичним процесом? (При розчиненні відбувається подрібнення речовини.)
- Чому розчинення не є фізичним процесом? (Тому що розчинення супроводжується тепловим ефектом - енергія хімічних зв'язків переходить у теплову.)
- Чому розчинення є хімічним процесом? (Руйнування одних хімічних зв'язків і утворення інших.)
- Чому розчинення не є хімічним процесом? (Тому що не відбувається утворення нових речовин.)
Висновок: розчинення є фізико-хімічним процесом.
2. ПРОЦЕС РОЗЧИНЕННЯ
Розповідається про процес розчинення твердих кристалічних речовин на прикладі натрій хлориду. У вузлах кристалічних решіток NaCl знаходяться заряджені частинки. Молекула води являє собою диполь, який має позитивно й негативно заряджені полюси.
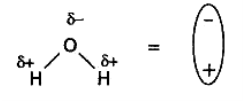
При потраплянні солі у воду її кристали оточуються молекулами води, котрі відповідним чином орієнтуються навколо позитивно й негативно заряджених іонів кристалічних решіток. Молекули води починають притягати іони до себе. Коли сила притягання іонів до молекул води стає більшою, ніж сила притягання до кристала, іон в оточенні молекул води переходить у розчин, вони називаються сольватами, а у випадку водяних розчинів - гідратами.
3. КРИСТАЛОГІДРАТИ
Якщо в контакті знаходяться вода та кристали якої-небудь розчинної речовини, то поряд із процесом розчинення відбувається зворотний процес - кристалізація. Спочатку, коли концентрація речовини в розчині невелика, розчинення відбувається швидко, а кристалізація - повільно. У міру збільшення концентрації речовини швидкість розчинення зменшується, а швидкість кристалізації збільшується. Стан насиченості це динамічна рівновага кристала речовини із розчином. При розгляді цього питання доречно згадати принцип ЛєШательє і застосувати його до такої реакції: Речовина кристал ↔ Речовина розчин
Утворення кристалогідратів можна пояснити тим, що при кристалізації деякі речовини не встигають (чи їм енергетично не вигідно) позбутися своєї «оболонки» з молекул води і кристалізуються разом з нею. На відміну від розчинів, у кристалогідратах кожна молекула речовини оточена певною, характерною для речовини кількістю молекул води. Склад таких речовин можна встановити і записати у вигляді хімічної формули. Приклади кристалогідратів п'ятиводний купрум сульфат (CuSO4· 5H2O) - мідний купорос, десятиводний натрій сульфат (Na2SO4 · 10H2O) - глауберова сіль.
4. РОЗВ'ЯЗУВАННЯ ЗАДАЧ ІЗ ЗАСТОСУВАННЯМ ПОНЯТТЯ ПРО КРИСТАЛОГІДРАТИ.
1. Кристалогідрат купрум (II) сульфату масою 5 г розчинили в 5 мл води. Розрахуйте масову частку солі в добутому розчині.

2. Яку масу глауберової солі необхідно додати до 100 мл 8% -го розчину натрій сульфату (густина 1,07 г/мл), щоб подвоїти масову частку речовини в розчині?

3. 25 г мідного купоросу розчинили у 135 води. Визначте масову частку розчиненої речовини (M(CuSO4) = 160 г/моль, a M(CuSO4 · 5Н2О) = 250г/моль). (10%)
4. Яку масу мідного купоросу й води треба взяти для приготування 40 кг 20% -го розчину купрум сульфату?
VI. Закріплення знань учнів.
Завдання:
Побудуйте графік розчинності мідного купоросу CuSO45H2О в воді за наступним даним:
|
Температура, ºС |
Розчинність, г/л |
|
0 |
150 |
|
10 |
170 |
|
20 |
190 |
|
30 |
240 |
|
40 |
290 |
|
50 |
340 |
|
60 |
390 |
Використовуючи графік визначте:
- Яку масу CuSO4 ·5H2 O можна розчинити в 100 мл води при 40 ºС.
- Припустіть яку масу CuSO4 ·5H2 O можна розчинити в 1 л води при 70 ºС.
- Яка маса солі CuSO4 ·5H2 O випаде в вигляді кристаликів з розчину, котрий приготували з 340 г солі и 1 л води при 50 ºС и охолодили до 30 ºС.
VIІ. Завдання додому.
- Вивчити §4 підручника.
- Виконати завдання після параграфа
- Виготовити самостійно кристал з розчину мідного купоросу
VIIІ. Підсумок уроку.
Підсумовується робота учнів на уроці, визначаються змістовні і слабкі відповіді, виставляються оцінки за урок.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ:
Література:
- Попель П.П. Хімія: підруч. для 9 кл. загальноосвіт. навч. закл. / П.П.Попель, Л.С.Крикля – К.: ВЦ «Академія», 2009 – 232 с.: іл. (книга двох авторів).
- Дігавцова Л.Ю. Хімія. 9 клас : Плани-конспекти уроків на друкованій основі / Л. Ю. Дігавцова — Х. : Вид-во «Ранок», 2013. — 128 с. — (Серія «Конструктор уроку»). (книга одного автора).
- Старовойтова І.Ю. Усі уроки хімії 9 клас / І.Ю.Старовойтова, О.В.Люсай. – Х.: Вид. Група «Основа», 2009 – 239, [1]с.: іл.,табл. – (Серія « 12 – річна школа»). (книга одного автора).
- Григорович О.В. Хімія. 9 клас: Розширене календарне планування уроків / О.В. Григорович, О.М. Гостинникова, А.В. Трушина – Х.: Веста: Видавництво «Ранок», 2007. – 96 с. – (На допомогу вчителю). (книга трьох авторів).
- Ольховик М.М. Хімія. Підготовка до зовнішнього оцінювання. Тестові завдання / М.М. Ольховик, Л.І. Нікітенко– Х.: Країна мрій, 2008. – 104 с. (книга двох авторів).
- [Електронний ресурс]. – Режим доступу: http://disted.edu.vn.ua/courses/learn/1893 (електронне джерело).
- [Електронний ресурс]. – Режим доступу: https://www.youtube.com/watch?v=1pRdKf1DQB4/ (електронне джерело).
- [Електронний ресурс]. – Режим доступу: http://www.myshared.ru/slide/779045/ (електронне джерело).
- [Електронний ресурс]. – Режим доступу: http://disted.edu.vn.ua/courses/learn/2205 (електронне джерело).
- [Електронний ресурс]. – Режим доступу: http://edufuture.biz/index.php?title=Розчинність,_її_залежність_від_різних_чинників._Фізико-хiмічна_суть_процесу_розчинення._Поняття_про_кристалогідрати (електронне джерело).
1


про публікацію авторської розробки
Додати розробку
