Презентація «Ступінь окиснення елементів» 8 клас
Про матеріал
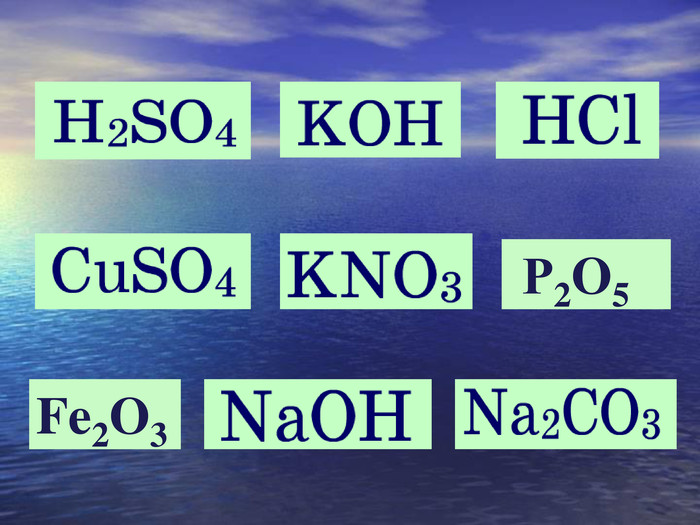
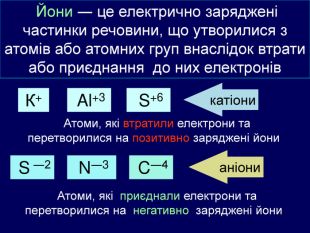
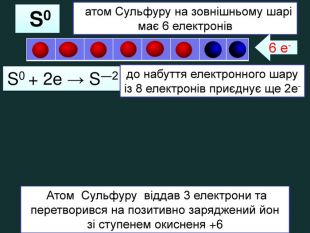
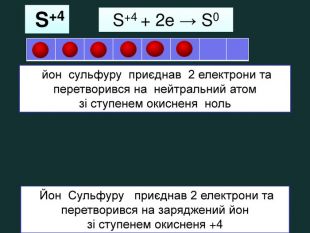
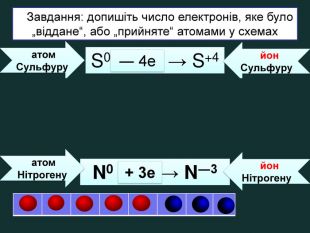
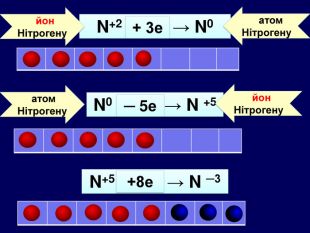
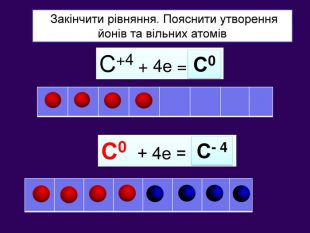
| Презентація допоможе навчити визначати ступінь окиснення елементів та складати формули сполук. Використано схеми-моделі останнього енергетичного рівня атомів.(до підручника Григорович О.В. Хімія 8 клас Вид-во «Ранок», 2016) |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
Дякую!
-
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку