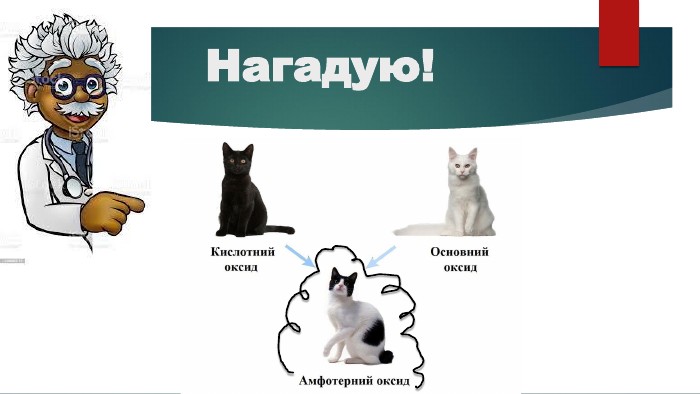
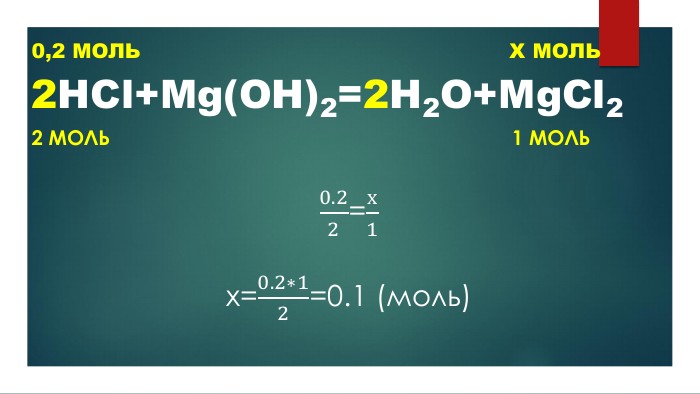
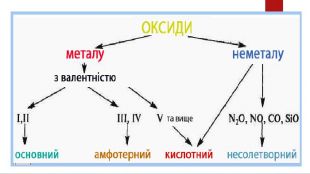
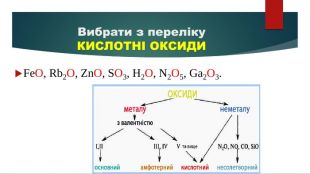
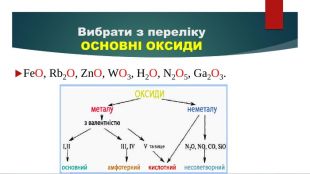
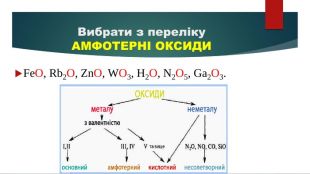
Презентація "Властивості оксидів"
Про матеріал
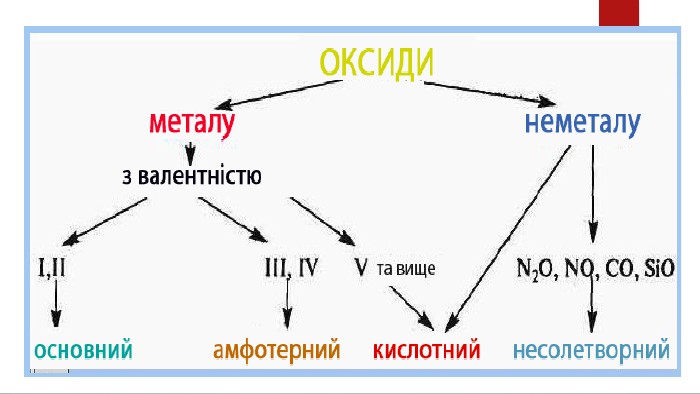
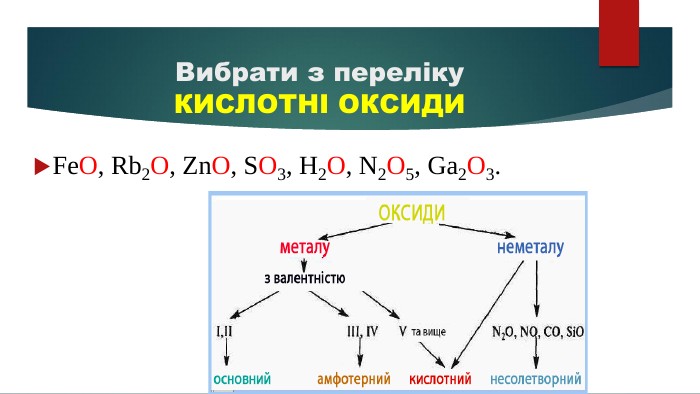
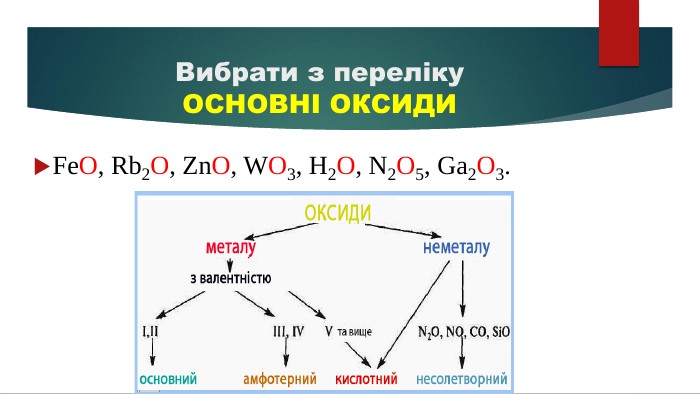
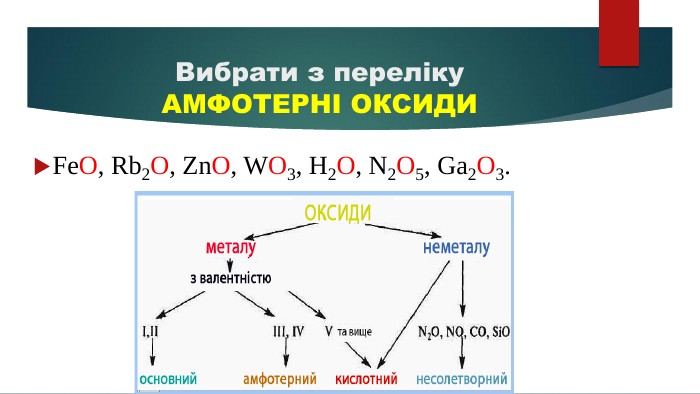
Допоможе наочно пояснити тему "Властивості оксидів" у 7-8 класах. Стане в нагоді під час розв'язування рівнянь. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дуже дякую!
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку