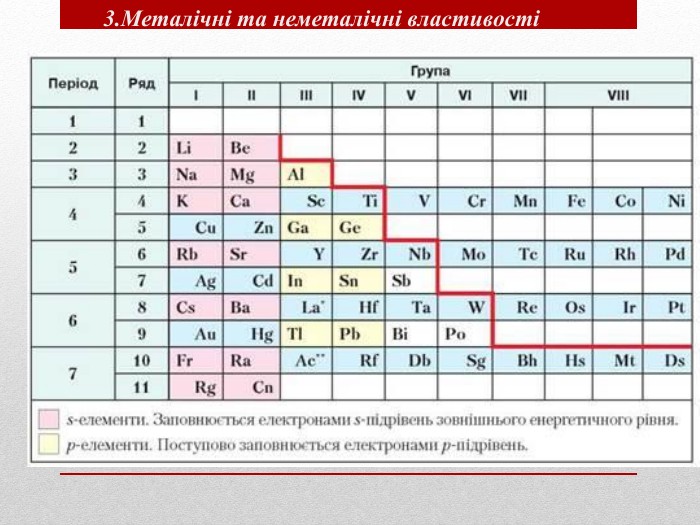
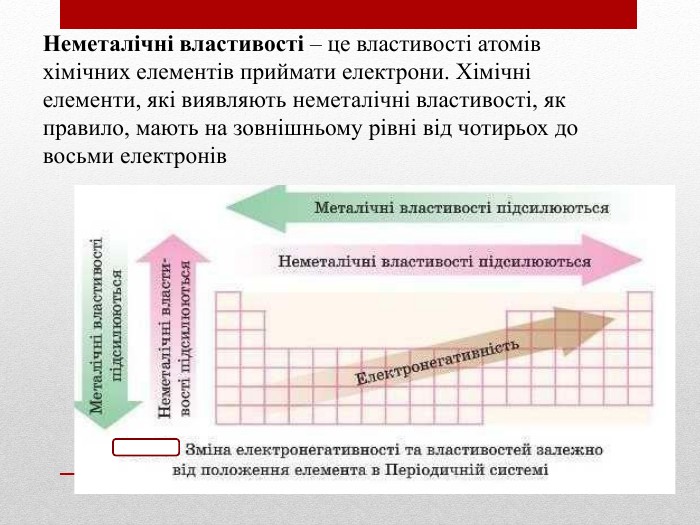
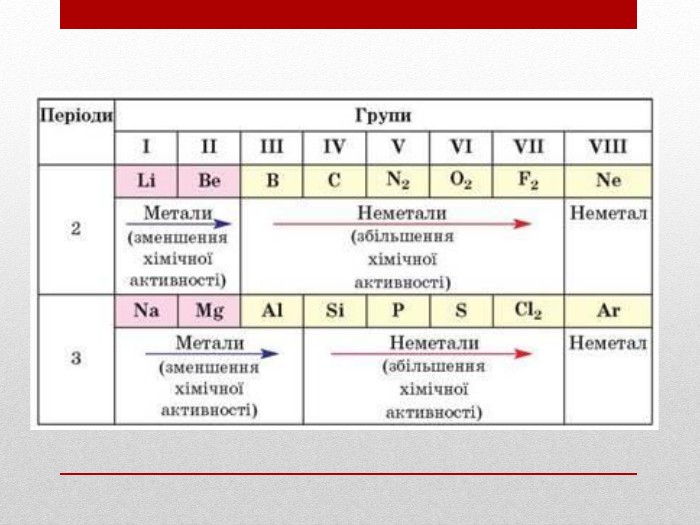
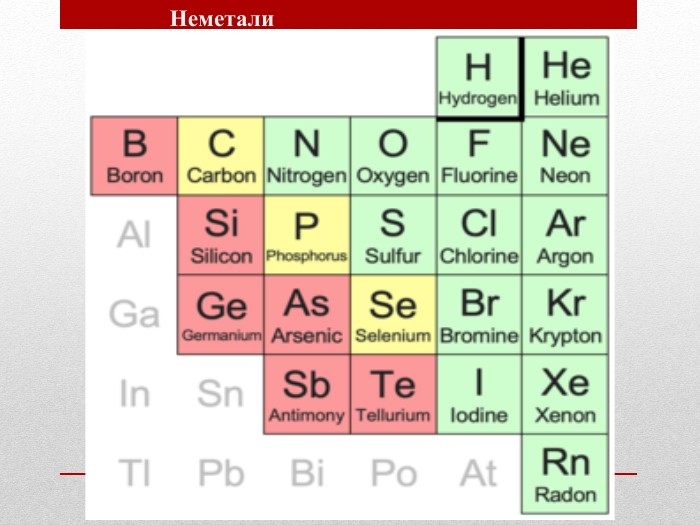
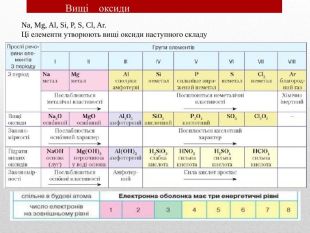
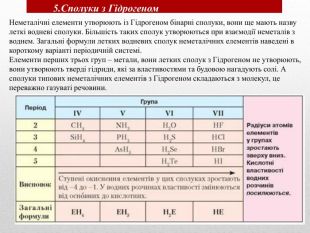
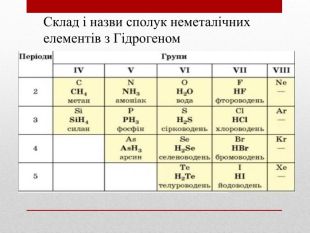
Презентація :"Взаємозв'язок між будовою електронних оболонок і властивостями хімічних елементів, простих речовин, сполук елементів з Гідрогеном та Оксигеном"
Про матеріал
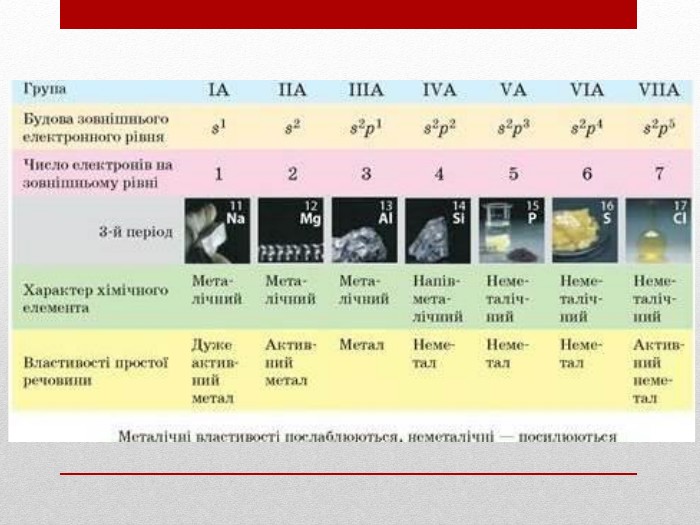
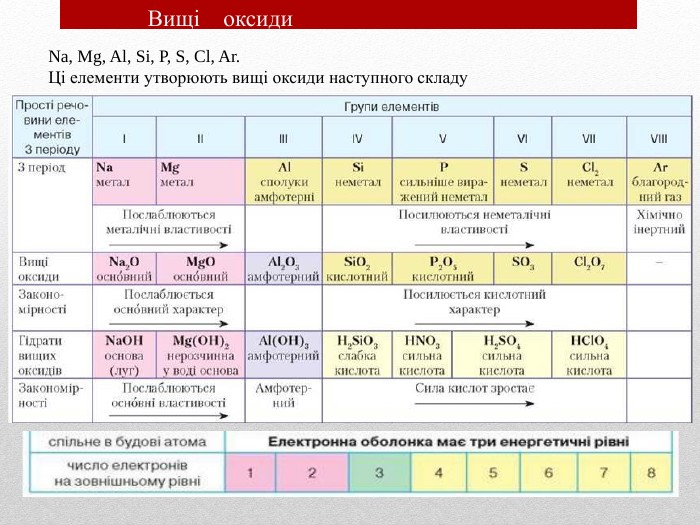
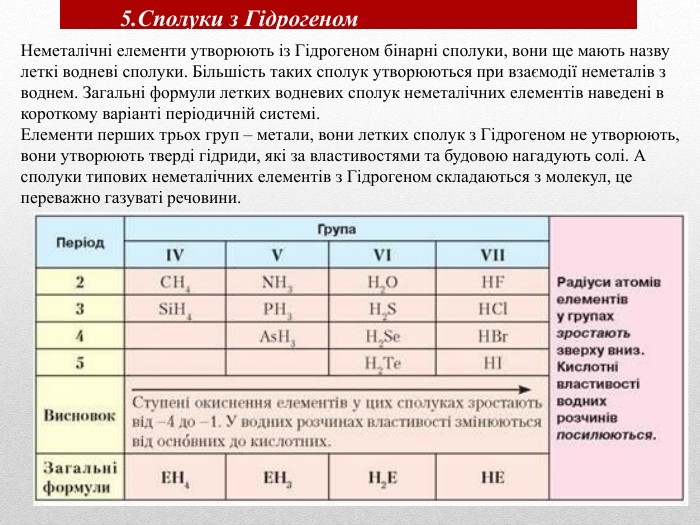
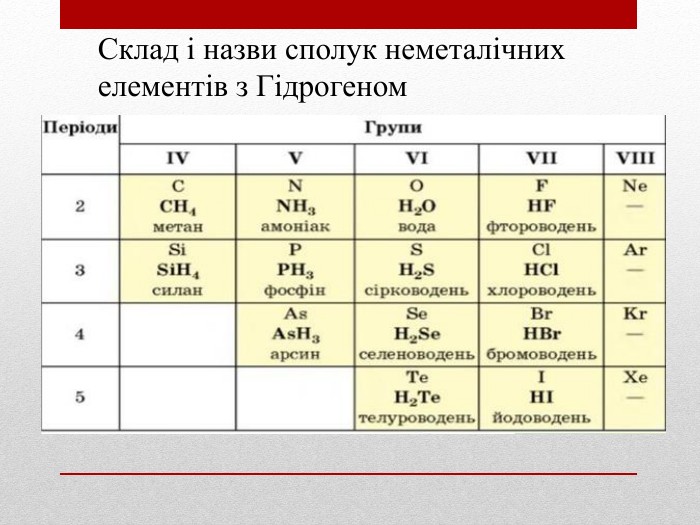
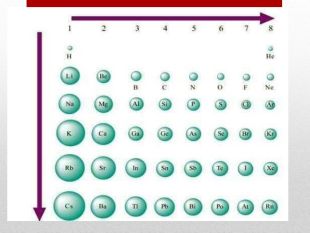
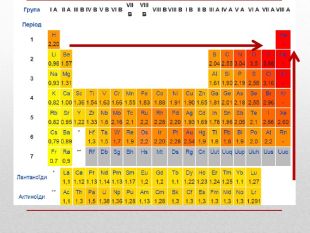
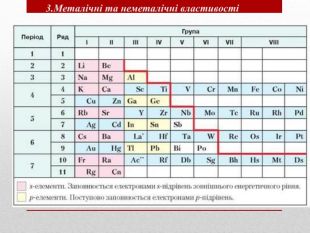
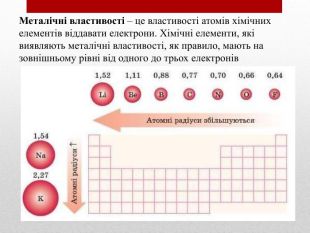
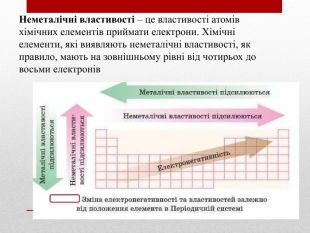
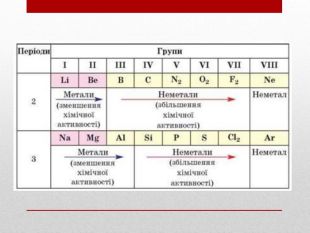
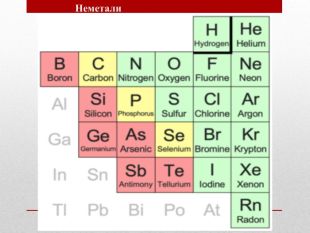
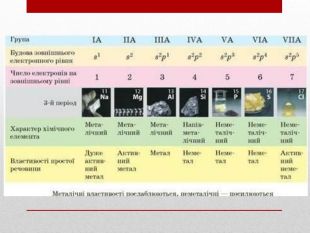
Презентація допоможе учням та вчителю при проведенні уроку"Взаємозв'язок між будовою електронних оболо¬нок і властивостями хімічних елементів, простих речовин, сполук елементів з Гідрогеном та Оксигеном"
Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку