Презентація «Йонний зв’язок, його утворення» 8 клас
Про матеріал
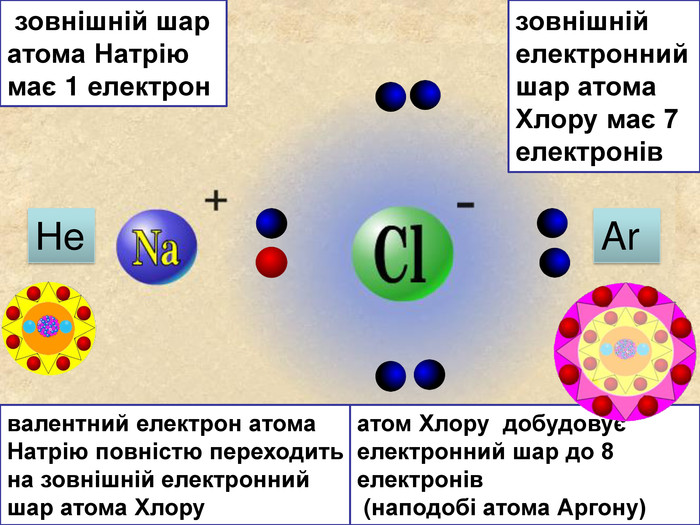
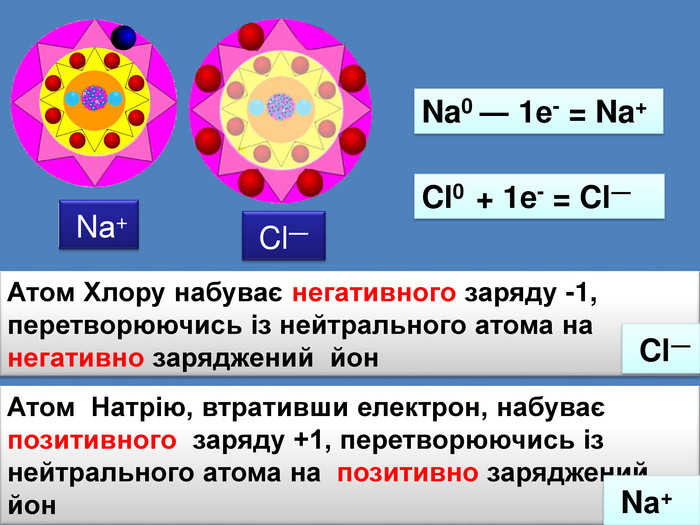
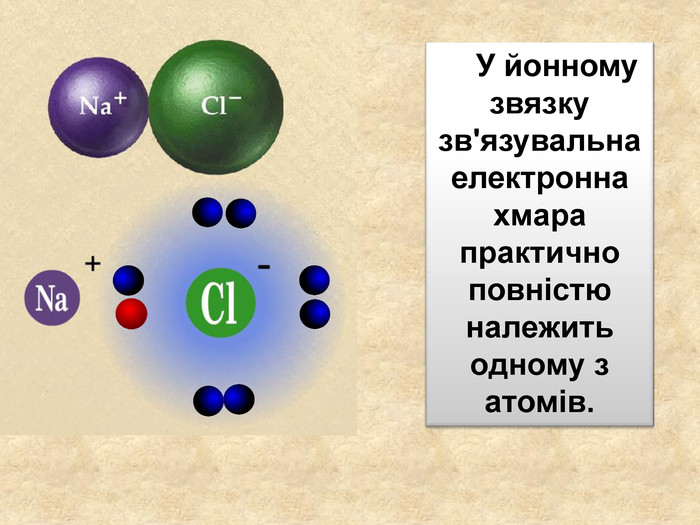
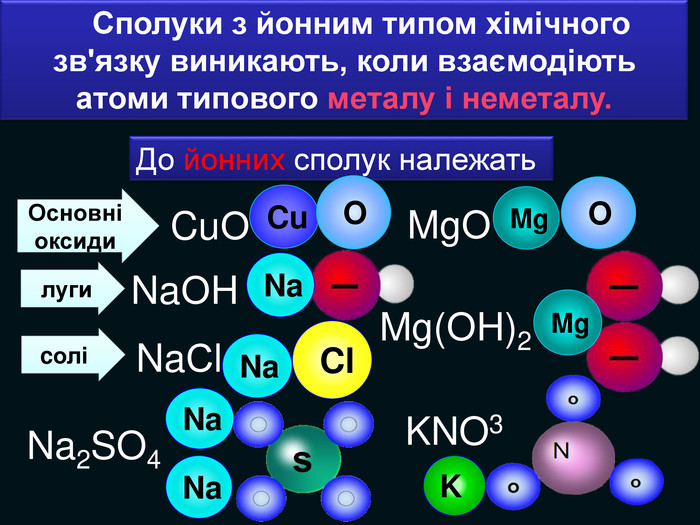
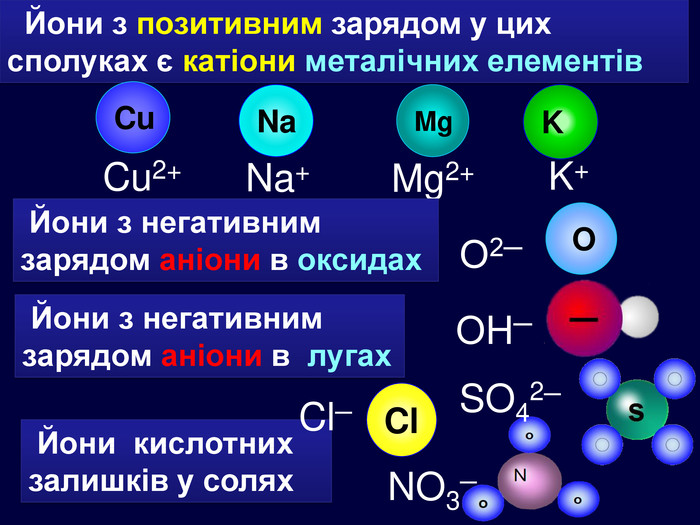
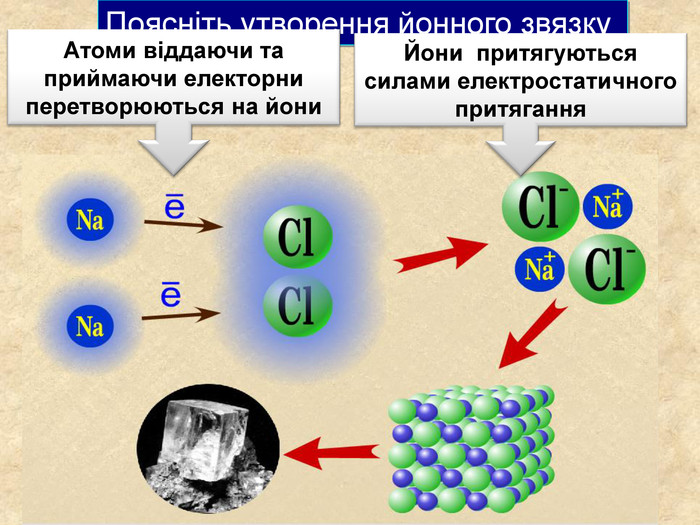
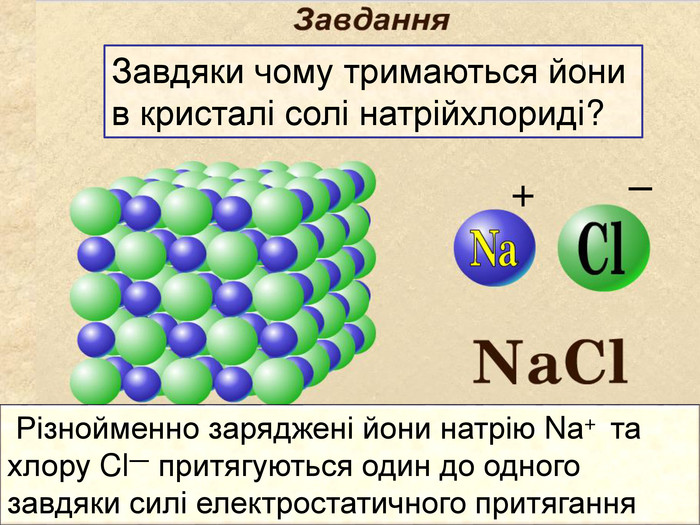
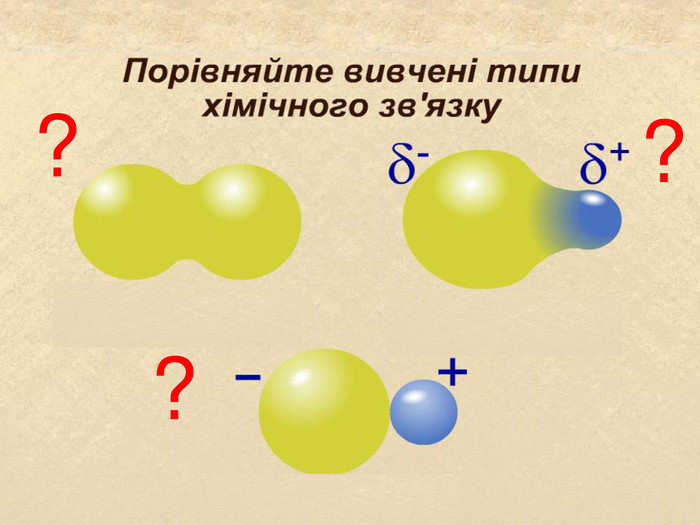
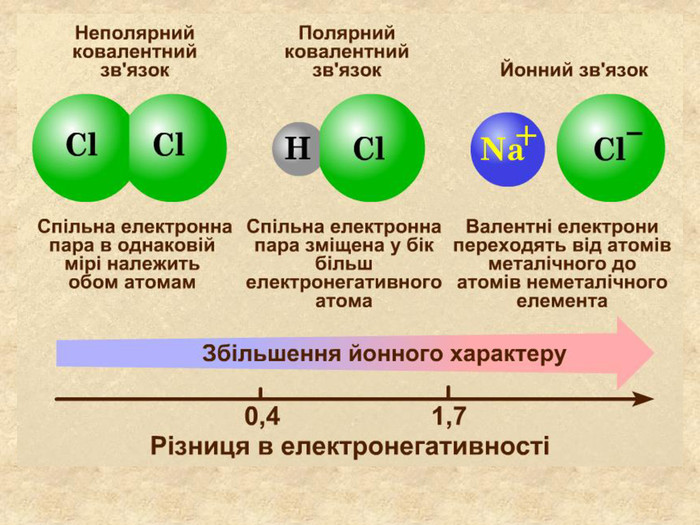
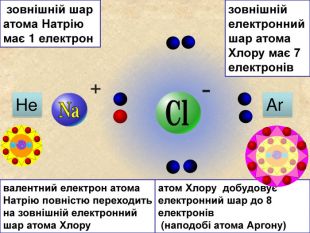
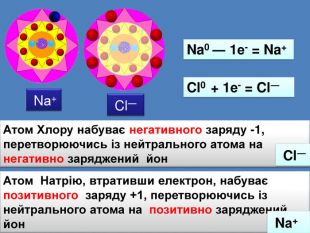
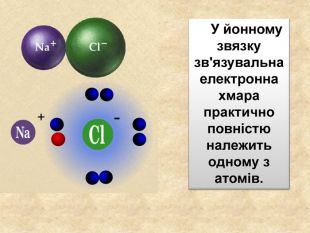
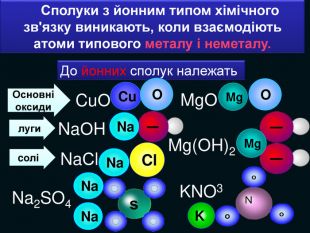
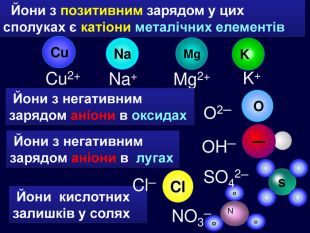
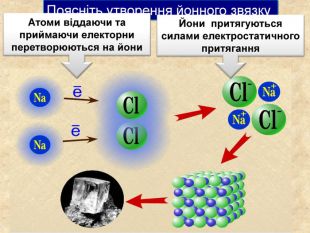
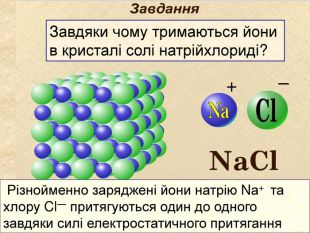
| Презентація допоможе в проведенні уроку на тему: «Йонний зв'язок, його утворення». Показано схеми утворення сполук із йонним хімічним зв'язком. |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку













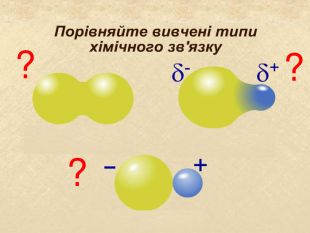
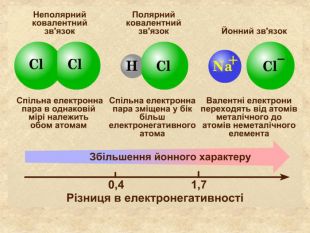


-

Бузницька Ольга Миколаївна
27.11.2023 в 17:35
Дякую, колего!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Юсин Надія Улянівна
10.09.2023 в 22:42
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Казімко Ольга Сергіївна
27.11.2022 в 16:44
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Остаповець Юрій
20.11.2022 в 21:55
Дякую.Все класно. Бажаю мирного неба!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
06.11.2022 в 18:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рибачок Наталія Борисівна
17.11.2021 в 03:09
Дякую. Кілька років пройшло від публікації, а презентація актуальна і виглядає нормально (шрифти, кольори).
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Герасименко Юлия
21.01.2021 в 18:58
дякую. яскраво й доступно
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бобрик Натали
19.01.2021 в 16:38
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рябченко Віталік
25.11.2020 в 22:58
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рибіна Олена Олександрівна
05.11.2018 в 23:32
добре
Загальна:
4.0
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
4.0
Показати ще 7 відгуків