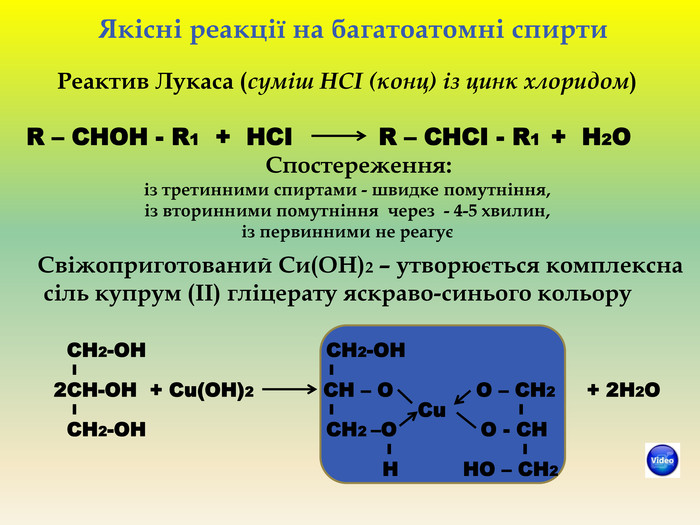
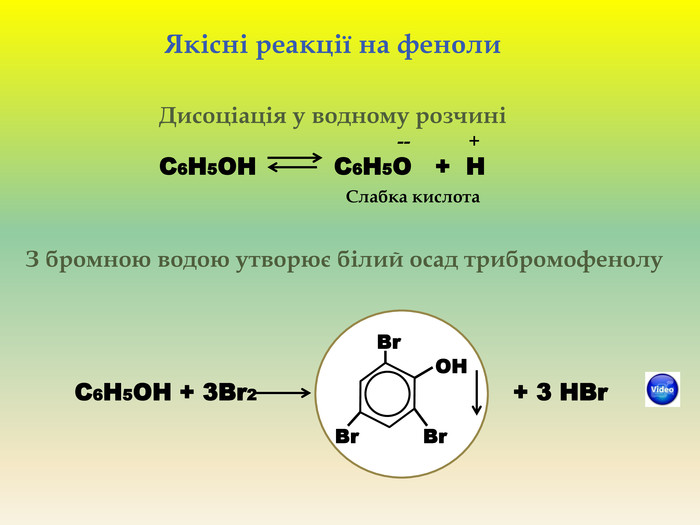
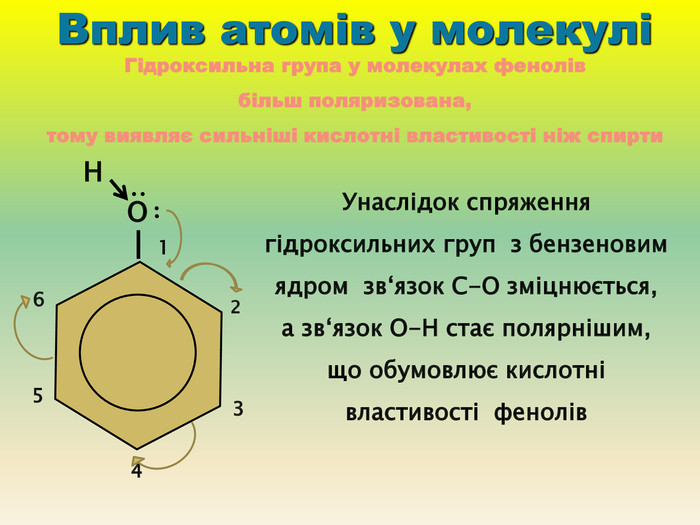
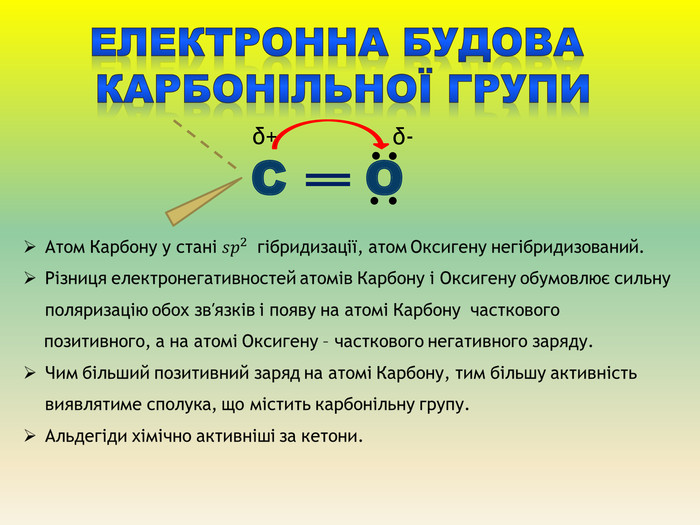
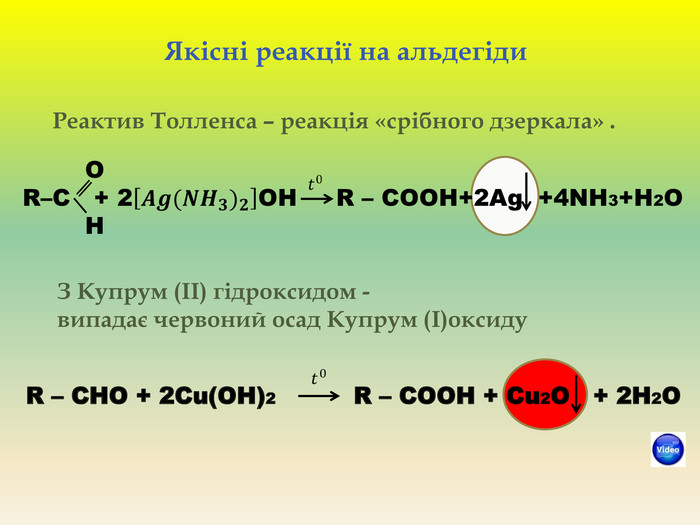
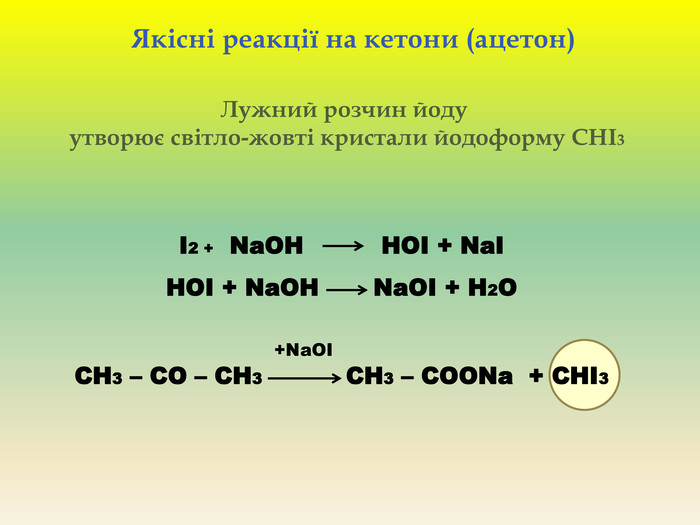
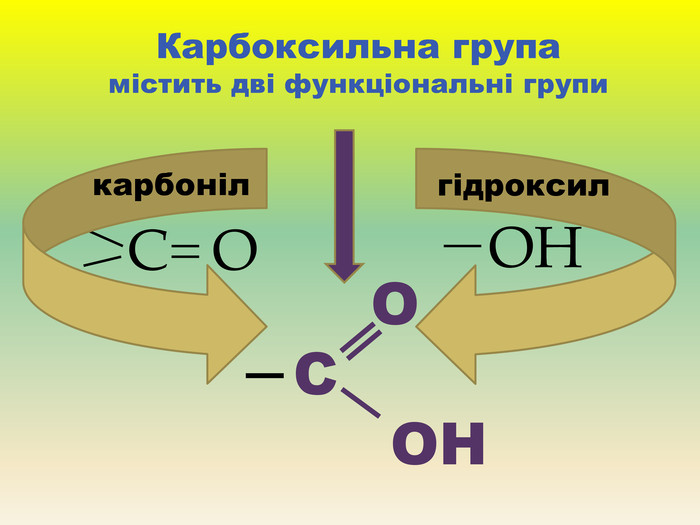
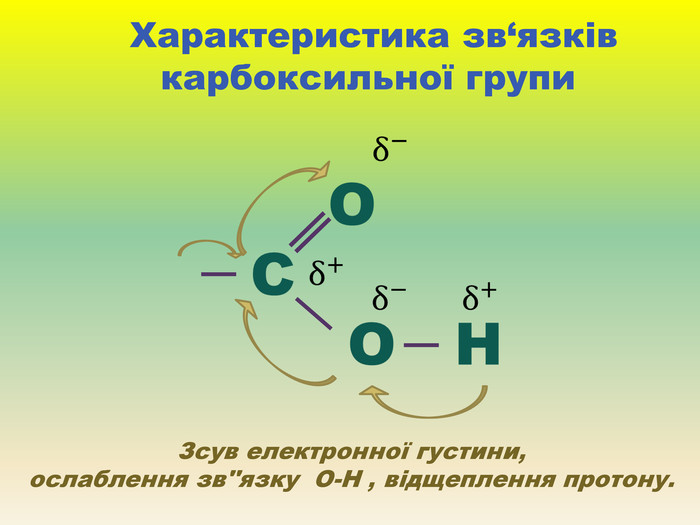
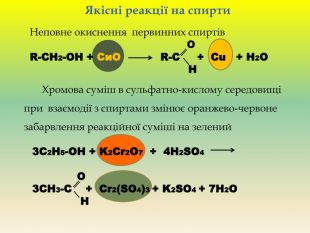
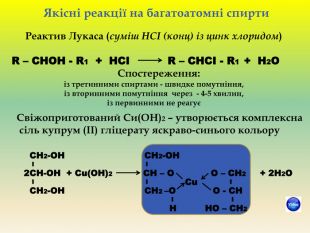
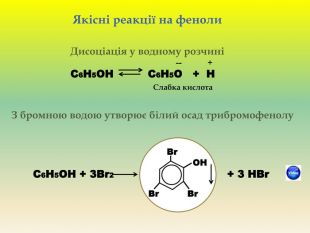
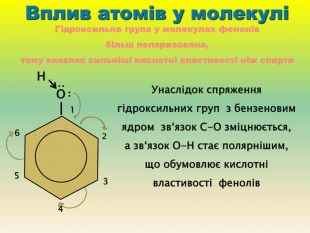
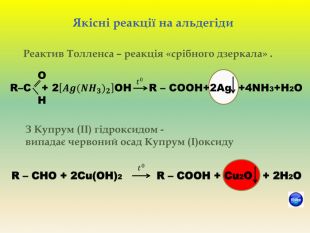
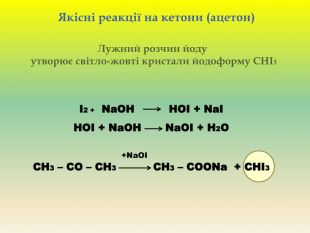
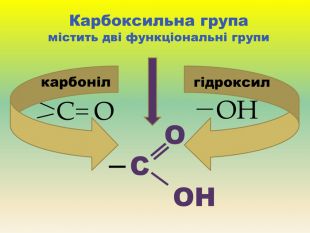
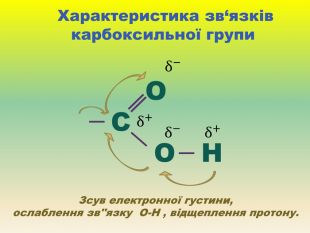
Презентація з теми "Оксигеновмісні органічні сполуки"
Про матеріал
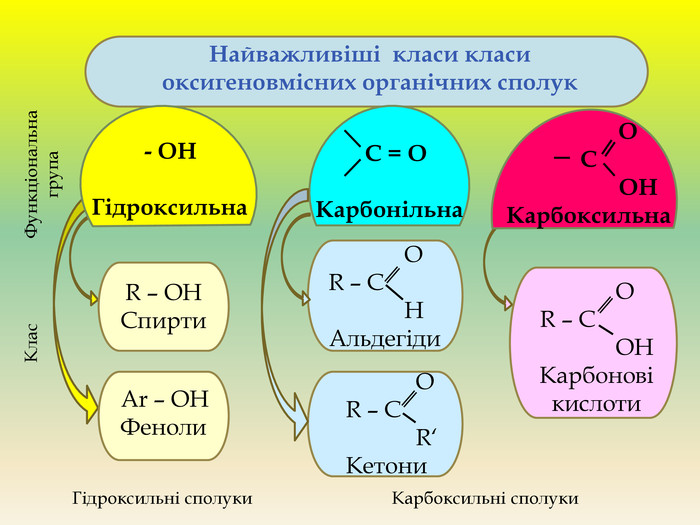
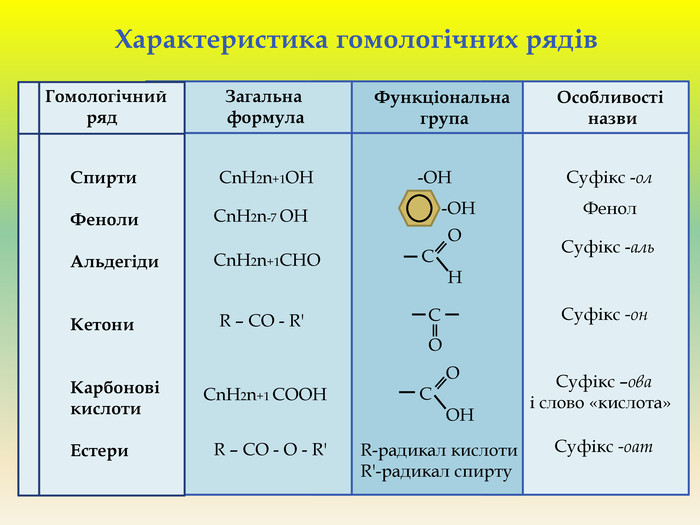
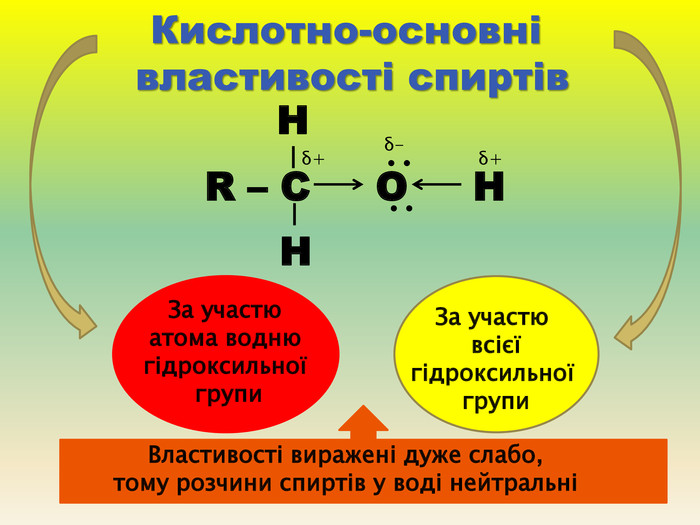
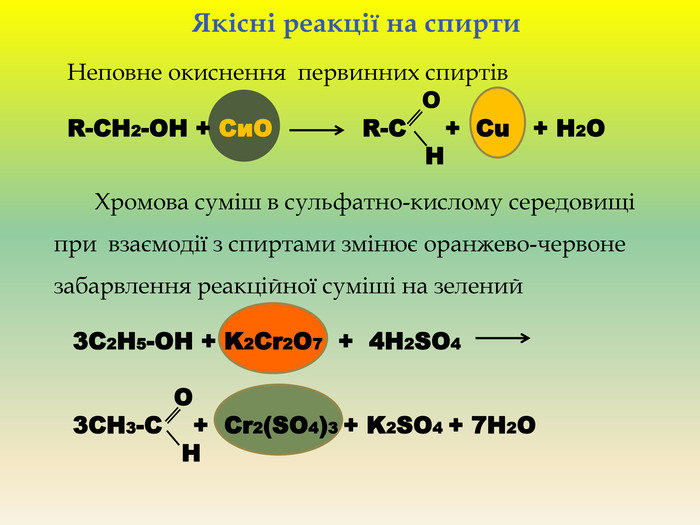
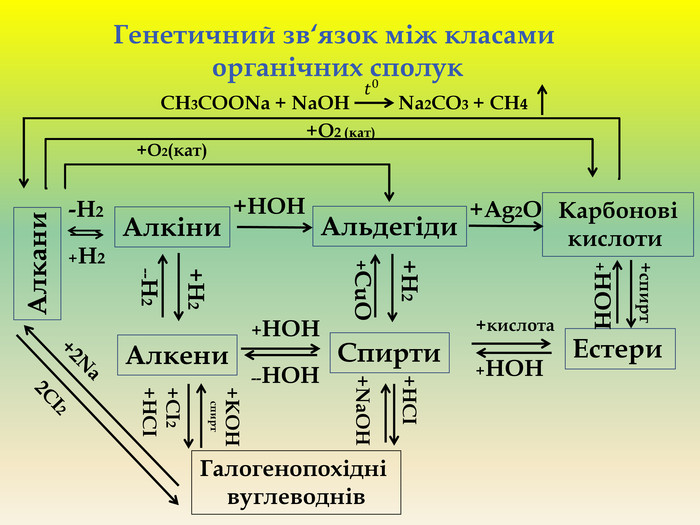
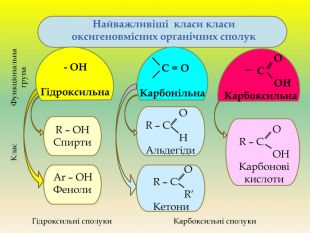
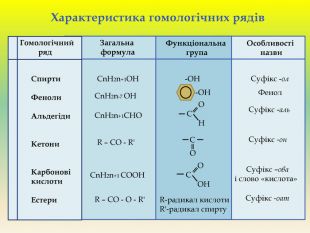
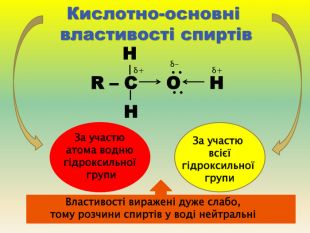
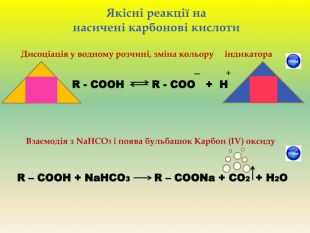
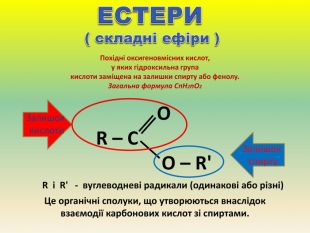
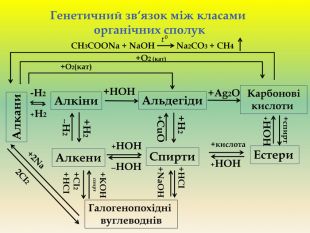
Презентація для учнів 9 класу що допоможе у вивченні теми "Оксигеновмісні органічні речовини". Презентація вміщює класифікацю основних класів оксигеновмісних органічних сполук та їх коротку характеристику. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую
-
-
Дякую.
ppt
До підручника
Хімія 9 клас (Савчин М.М.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку