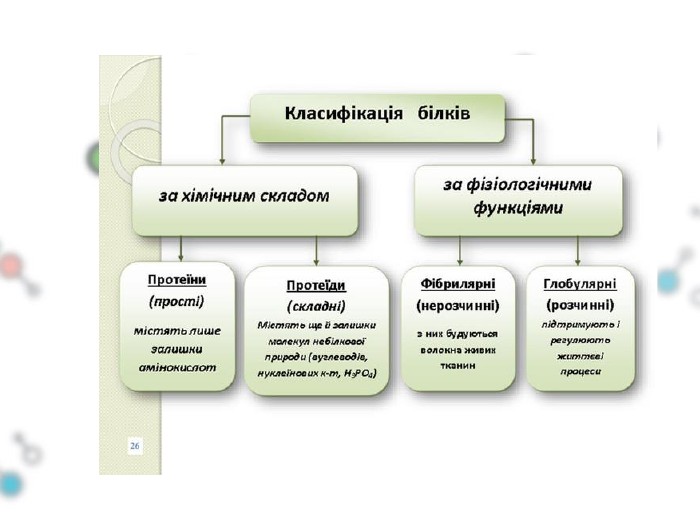
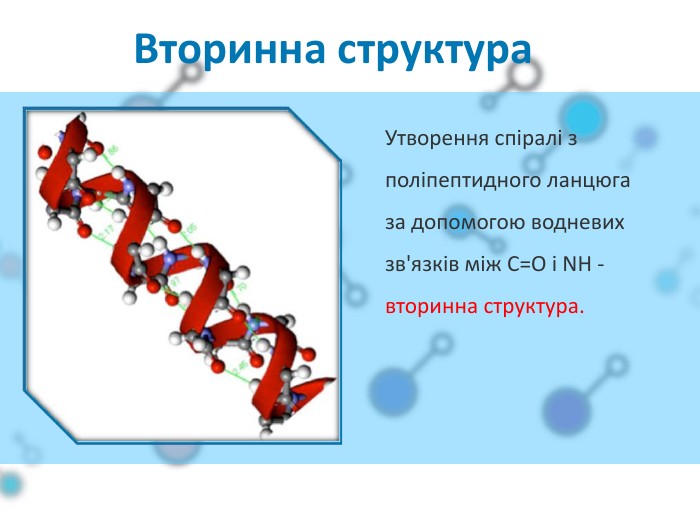
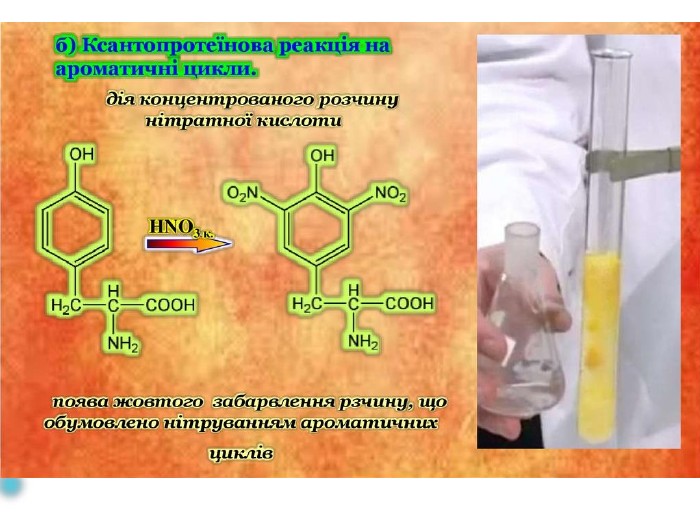
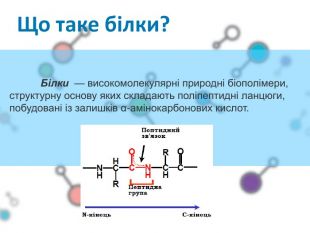
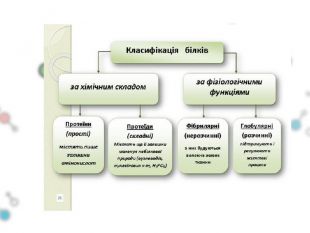
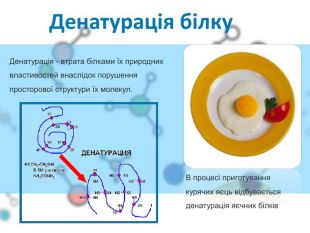
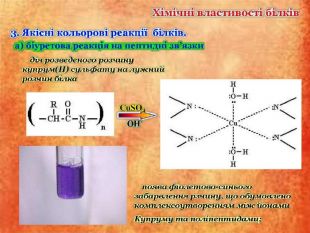
Презентаційний матеріал до заняття з хімії по темі "Білки"
Про матеріал
Презентаційний матеріал-супровід заняття з хімії з теми "Білки", допоможе студентам та учням засвоїти складний матеріал та зрозуміти складність будови біополімерів Перегляд файлу
Зміст слайдів
ppt
До підручника
Хімія (профільний рівень) 10 клас (Буринська Н.М. та інші)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку