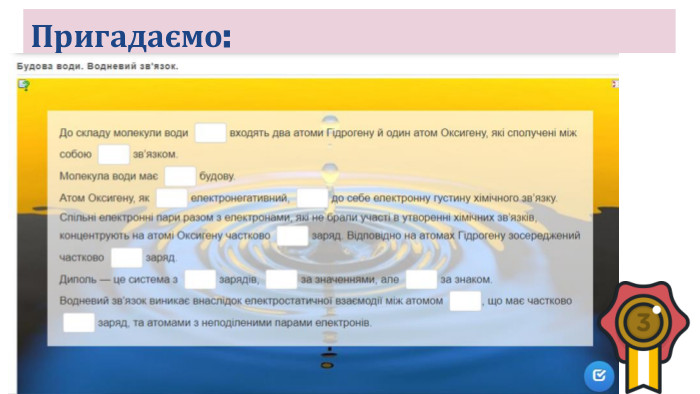
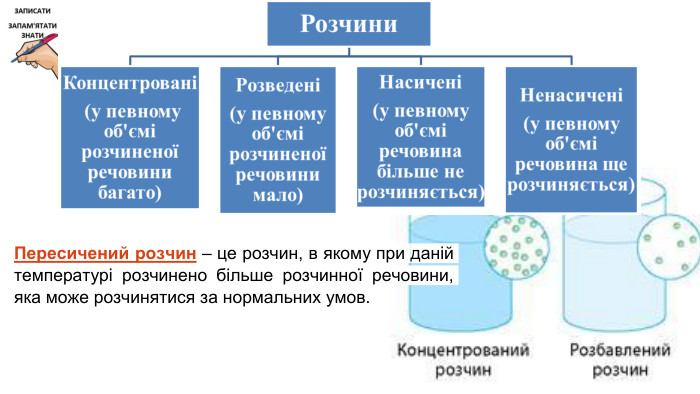
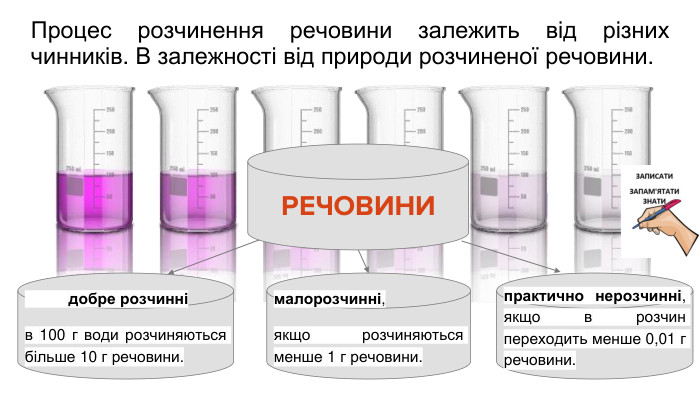
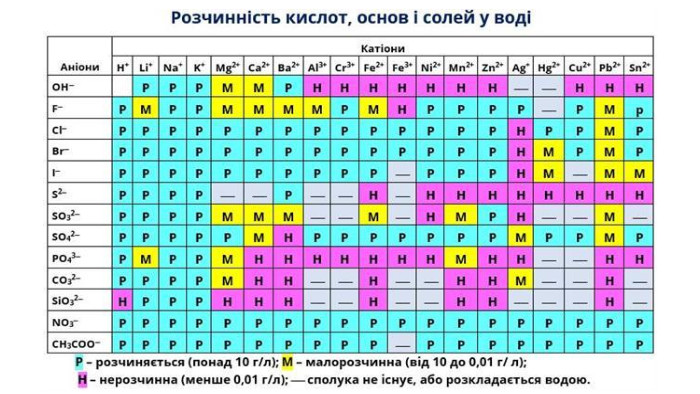
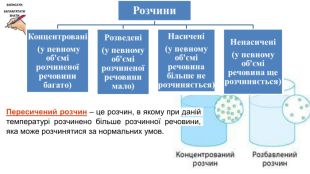
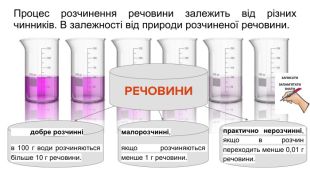
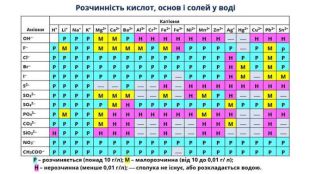
Розчинність речовин, її залежність від різних чинників. Насичені й ненасичені, концентровані й розведені розчини.
Про матеріал
Презентація до уроку "Розчинність речовин, її залежність від різних чинників. Насичені й ненасичені, концентровані й розведені розчини". Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку