Що таке атом: від давнини до сучасних уявлень
ЩО ТАКЕ АТОМ: ВІД
ДАВНИНИ ДО СУЧАСНИХ

 УЯВЛЕНЬ
УЯВЛЕНЬ
БАКЛАНОВА ОЛЕНА
• Поняття “атом” вперше зустрічається у творах давньогрецьких філософів і означало найдрібніші, неподільні (гр. atomos – неподільний) частинки, з яких складається світ. Вважалось, що атоми вічні, здатні рухатись і мають настільки малі розміри, що виміряти їх неможливо.

• Ідея про те, що всі тіла складаються з найдрібніших неподільних частинок – атомів, висловлювалася ще в давнину. Наприклад, в давньоіндійських філософських школах атом розглядався як елементарна неподільна частка світу. В Європі атомістичні уявлення були викладені в працях давньогрецького філософа Левкіппа і були в подальшому розвинені і систематизовані його учнем Демокрітом.
• За Демокріту, рух атомів був причиною всього, що відбувається у Всесвіті. Платон вважав, що атоми мають форму чотирьох правильних багатогранників, по числу «елементів». Атоми землі мають форму куба, води – форму ікосаедра, повітря – октаедра, вогню – тетраедра. А форму додекаедру, за Платоном, має весь Всесвіт.
• Стародавні атомістичні уявлення були більш умовними, в їх основі лежало мало досвідчених даних. Вони також давали мало можливостей для якихось наслідків і розвитку наукових теорій.
• Такі уявлення про атоми були поширені до початку ХХ ст. Перші докази складності будови атома були одержані при вивченні проходження електричного струму через рідини і гази (М. Фарадей). Було встановлено, що електрика існує у вигляді окремих одиничних зарядів, які під дією електричного поля у вакуумі відхиляються до катода (позитивний полюс). Ці “катодні промені” (У. Крукс, 1876 р.) – мали негативний заряд і були названі електронами (Дж. Томсон, 1907 р.). В. Рентген (1895 р.) відкрив новий вид випромінювання – електромагнітні промені (названі ним Хпромені, зараз – рентгенівське випромінювання), які випускає речовина при попаданні на неї катодних променів.
• Ще одним свідченням складності будови атомів стало відкриття здатності атомів певних елементів самовільно розпадатись. Це явище дістало назву “радіоактивність” (А. Бекерель (1896 р.), подружжя Ж. Кюрі і М.
Склодовська-Кюрі (1898 р.)).
• Подальші відкриття ядра, протона, нейтрона, визначення зарядів елементарних частинок, надихнули вчених на створення моделей атома. Першу модель атома запропонував Дж. Томсон у 1903 р. Атом він уявляв як певну кількість позитивно зарядженої речовини – “тіло атома”, у яку вкраплені негативно заряджені електрони (як родзинки у булку) (рис.
4.1). Сумарний заряд електронів в електронейтральному атомі приймався рівним заряду позитивно зарядженого тіла атома.
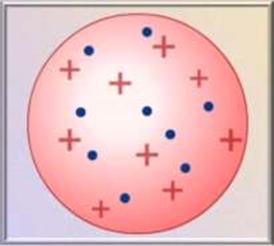 Модель атома Томсона
Модель атома Томсона
• Подальше вивчення Е. Резерфордом (1907 р.) проходження aчастинок (ядра Не2+) через тонку металічну (срібну або золоту) фольгу показало, що більшість з них проходить через фольгу вільно і лише деякі змінюють траєкторію руху. Це навело вченого на думку, що атом побудований на зразок сонячної системи, тому запропонована ним модель атома була названа “планетарна модель будови атома”
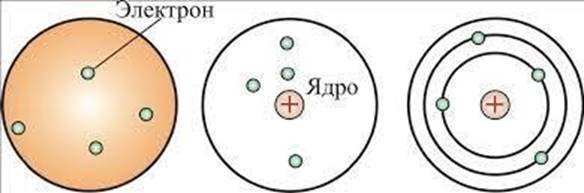 Модель атома по Резерфорду
Модель атома по Резерфорду
• Згідно Резерфорду, у центрі системи (атома) розміщене маленьке позитивно заряджене ядро, в якому сконцентрована майже вся маса атома. Навколо ядра рухаються електрони (планети), кількість яких визначається зарядом ядра, який чисельно рівний порядковому номеру елемента у Періодичній системі Д.І. Менделєєва (Г. Мозлі, 1913 р.). Усі електрони утворюють електронну оболонку атома. Максимальна відстань від ядра атома до найдальшої точки траєкторії руху електронів визначає розмір атома – атомний радіус.
• Однак, планетарна модель атома Резерфорда мала певні недоліки. Одним з найочевидніших було те, що при обертанні електрон має втрачати енергію і наближатись до ядра, врештірешт впавши на нього, що призвело б до зникнення атома. Однак цього ніколи не відбувається.
• Для усунення цієї та деяких інших суперечностей, Н. Бор (1913 р.) запропонував доповнити теорію будови атома Резерфорда постулатами (положення, які приймають без доведення):
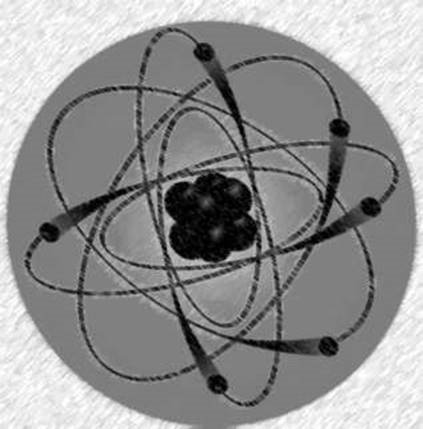 - електрон може рухатись навколо ядра лише по певних колових – стаціонарних – орбітах;
- електрон може рухатись навколо ядра лише по певних колових – стаціонарних – орбітах;
-рухаючись по стаціонарній орбіті електрон не випромінює і не поглинає енергію.
• Накопичення фізичних і хімічних даних дозволило філософам поновому поглянути на атомізм. Такі явища, як щільність, міцність, дифузія, хімічні взаємодії вказували на те, що всі речовини складаються з найдрібніших частинок, кожна з яких має всі властивості речовини.
• Зокрема, Р. Бойль, досліджуючи поведінку газів при зміні температури і тиску, спирався на атомістичні уявлення, що послужили згодом основою молекулярно-кінетичної теорії.
• Ідеї атомізму були розширені і доповнені в працях Д. Дальтона, який ототожнював поняття «атом» і «хімічний елемент», два його закони, що стосуються тиску і розчинності газової суміші, спираються саме на це уявлення.
• Розвиток хімії дозволило відкрити такі властивості атомів, як
«атомна вага», «валентність», а до середини XIX ст. і «заряд» (одночасно було введено поняття «йон»).
• Після відкриття електрона і складної будови атома на початку ХХ ст. уявлення про «неподільність» атомів завдяки роботам Дж. Томсона, М. Планка, А. Ейнштейна, Е. Резерфорда змінилися теорією атомної будови. Атоми виявилися складними структурами, що складаються з ядра, що містить майже всю масу і електронних оболонок, що визначають хімічні властивості.
• Одночасно в роботах Л. де Бройля, Е. Шредінгера, В. Гейзенберга, П. Дірака були відкриті квантово-механічні уявлення про процеси, що відбуваються в атомі.
• З точки зору сучасної науки атоми – це лише одна із сходинок організації матерії, яка, в свою чергу, представлена більш дрібними і більш «глубокими» ступенями.
ІСТОРІЯ АТОМА: ТЕОРІЇ ТА МОДЕЛІ

• Вже після Шредінгера, 1932 року англійський фізик Джеймс Чедвік (учень Ернеста Резерфорда) виявив існування нейтрона, завершуючи нашу картину субатомних частинок, що становлять атом. Однак історія не закінчується на цьому; Фізики виявили, що протони та нейтрони, що становлять ядро, самі ділиться на частинки, звані кварками.
• 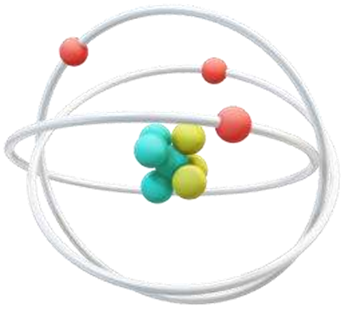 Принаймні модель атома дає нам відмінний приклад того, як наукові моделі можуть змінюватися з часом, і показує, як нові дані можуть призвести до появи нових моделей.
Принаймні модель атома дає нам відмінний приклад того, як наукові моделі можуть змінюватися з часом, і показує, як нові дані можуть призвести до появи нових моделей.
ДЖЕРЕЛА:
• 1. https://tut-cikavo.com/tekhnolohii/naukovi-facty/448-shcho-take-atom
• 2. http://zno.academia.in.ua/mod/book/view.php?id=3715&chapterid=1401
• 3. http://zno.academia.in.ua/mod/book/view.php?id=3715&chapterid=1401
• 4. https://probapera.org/publication/13/55880/istoriya-atoma.html
ДЯКУЮ ЗА УВАГУ!


про публікацію авторської розробки
Додати розробку
