Склад, властивості, застосування окремих представників вуглеводнів (метан, етан, етен, етин
10 клас Дата______
Урок №__
Тема уроку: Склад, властивості, застосування окремих представників вуглеводнів (метан, етан, етен, етин).
Цілі: 1. Формування ключових компетентностей:
- спілкування державною мовою;
- інформаційно-цифрова компетентність;
- уміння вчитися впродовж життя;
- екологічна грамотність і здорове життя.
2. Формування предметних компетентностей:
- узагальнити і систематизувати знання учнів про склад, властивості і застосування насичених і ненасичених вуглеводнів на прикладі метану, етану, етену і етину;
- розвивати вміння складати структурні і напівструктурні формули алканів, етену та етину; складати рівняння реакцій горіння вуглеводнів, хлорування метану, приєднання до етену та етину;
- виховувати дбайливе ставлення до природи, оцінювати вплив на здоров’я і довкілля окремих органічних речовин.
Обладнання: роздатковий матеріал, презентація до уроку, схеми "Класифікація вуглеводнів", "Гомологічний ряд вуглеводнів", Фізичні та хімічні властивості аліфатичних вуглеводнів".
Тип уроку: Комбінований урок повторення знань, умінь і навичок і творчого
застосування їх на практиці.
Форми роботи: фронтальна бесіда, робота в групах, складання опорного конспекту.
Структура уроку.
І. Організаційний етап.
ІІ. Актуалізація опорних знань учнів.
ІІІ. Повторення, узагальнення і систематизація знань.
- Класифікація вуглеводнів, їхні основні характеристики.
- Гомологічні ряди насичених і ненасичених вуглеводнів, їхні основні фізичні і хімічні властивості.
IV. Підбиття підсумків уроку
V. Домашнє завдання.
Хід уроку
І. Організаційний етап.
Оголошення теми і мети уроку.
ІІ. Актуалізація опорних знань . Мотивація навчальної діяльності.
Фронтальна бесіда.
- Які сполуки належать до органічних?
- Який розділ хімії називається органічною хімією?
- Які хімічні елементи входять до складу органічних сполук?
- Як відрізняються органічні та неорганічні сполуки за їх поширенням у природі?
- У чому полягає різниця між хімічними реакціями, в яких беруть участь органічні та неорганічні сполуки?
Особливості органічних речовин.
- Органічні речовини – це сполуки Карбону.
- Атоми Карбону здатні сполучатися між собою в ланцюги і утворювати молекули різноманітних форм.
- Характерні ознаки органічних речовин: ковалентні зв'язки, молекулярні кристалічні решітки, низька термостійкість, горючість, погана розчинність у воді.
- Органічні речовини становлять основу рослинних і тваринних організмів, з них виробляють харчові продукти, папір, тканини, барвники, лікарські та косметичні засоби, пластмаси, паливо тощо.
- Органічні речовини добувають з природної сировини, а також шляхом синтезу з інших органічних та неорганічних речовин.
- Поділ на органічні і неорганічні речовини є умовним.
ІІІ. Повторення, узагальнення і систематизація знань.
1. Класифікація вуглеводнів, їхні основні характеристики.
Запитання до учнів:
- Які сполуки відносять до вуглеводнів?
(Вуглеводні – це сполуки до складу молекул яких входять атоми Карбону і Гідрогену).
- Наведіть приклади вуглеводнів?
- Де в природі поширенні вуглеводні?
Викладач: Завдяки особливостям будови та властивостям Карбону його сполуки з
Гідрогеном є досить численними і різноманітними. Це зумовлено низкою структурних факторів.
Атоми Карбону здатні з'єднуватись між собою в ланцюги різної будови:
- С – С – С – С - нерозгалужений
С
l
‒ С – С – С ‒ розгалужений
l
С
C – С
l l замкнутий
C – С
За однакової кількості атомів Карбону в молекулах вуглеводні можуть відрізнятися числом атомів Гідрогену.
СН3 ‒ СН2 – СН2 ‒ СН3 С4Н10
СН2 = СН – СН2 ‒ СН3 С4Н8
СН2 = СН – СН = СН2 С4H6
CН – СН
ll ll С4H4
CН – СН
СН ≡ С ‒ С ≡ СН С4H2
Класифікацію вуглеводнів здійснюють за такими структурними ознаками, що визначають властивості цих сполук:
- будова карбонового ланцюга (карбонового скелета);
- наявність в ланцюзі кратних зв'язків С=С і С≡С (ступінь насиченості).
Схема 1:
|
|

 ациклічні
ациклічні
![]()
![]()
![]()



![]()
![]()
![]()

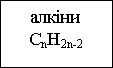
![]()
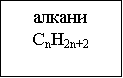
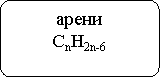
.
- Гомологічні ряди.
Колективна робота.
- Що таке гомологічний ряд?
Група ‒СН2 називається гомологічною різницею. Члени одного гомологічного ряду називаються гомологами.
Гомологи мають подібну будову і подібні хімічні властивості.
Таблиця 1. Гомологічний ряд вуглеводнів
|
Алкани |
Алкени |
Алкіни |
|||
|
назва |
формула |
назва |
формула |
назва |
формула |
|
метан |
СН4 |
- |
|
|
|
|
етан |
С2Н6 |
етен (етилен) |
С2Н4 |
етин (ацетилен) |
С2Н2 |
|
пропан |
С3Н8 |
пропен(пропілен) |
С3Н6 |
пропін |
С3Н4 |
|
бутан |
С4Н10 |
бутен |
С4Н8 |
бутин |
С4Н6 |
|
пентан |
С5Н12 |
пентен |
С5Н10 |
пентин |
С5Н8 |
|
гексан |
С6Н14 |
гепсен |
С6Н12 |
гексин |
С6Н10 |
|
гептан |
С7Н16 |
гептен |
С7Н14 |
гептин |
С7Н12 |
|
октан |
С8Н18 |
октен |
С8Н16 |
октин |
С8Н14 |
|
нонан |
С9Н20 |
нонен |
С9Н18 |
нонін |
С9Н16 |
|
декан |
С10Н22 |
децен |
С10Н20 |
децин |
С10Н18 |
Таблиця 2. Фізичні властивості аліфатичних вуглеводнів.
|
Кількість атомів Карбону |
Молекулярна маса |
tпл |
tкип |
Агрегатний стан |
||
|
Алкани |
Алкени |
Алкіни |
||||
|
2 4 6 8 10 12 14 16 18 20 |
С1 ‒ С4 - гази |
С2 ‒ С4 - гази |
С1 ‒ С4 - гази |
|||
|
С5 ‒ С17 - рідини |
С5 ‒ С15 - рідини |
С5 ‒ С16 - рідини |
||||
|
від С16 - тверді |
||||||
|
від С18 - тверді |
від С17 - тверді |
|||||
Викладач: всі вуглеводні – безбарвні речовини; газоподібні і тверді
вуглеводні не мають запаху, а середні представники гомологічних рядів мають специфічний запах; практично не розчиняються у воді, але добре розчиняються в органічних розчинниках. (Учні записують таблиці в зошит).
Таблиця 3. Хімічні властивості вуглеводнів
|
Власти- вості |
Вуглеводні |
||
|
Насичені |
Ненасичені |
Ароматичні |
|
|
Горючість |
2С2Н6+7О2→4СО2+6Н2О |
С2Н4+3О2→СО2+2Н2О |
2С6Н6+15О2→12СО2+6Н2О |
|
Термічний розклад |
СН4→С2Н2+3Н2 С2Н6→2С+3Н2 |
С2Н2→2С+Н2 |
С6Н6→6С+3Н2 |
|
Реакція заміщення |
СН4+Cl2→СН3Cl+НCl |
Не характерні за звичайних умов |
С6Н6+Cl2→С6Н5Cl+НCl |
|
Приєднання водню |
не можливо |
С2Н2+Н2→С2Н4 |
С6Н6+3Н2→С6Н12 |
|
Приєднання галогенів |
не можливо |
С2Н4+Cl2→С2Н4Cl2 |
С6Н6+3Cl2→С6Н6Cl6 |
|
Взаємодія з рoзчином KMnO4 |
не реагують |
Легко окислюються (знебарвлення розчину) |
Окислюються важко |
|
Взаємодія з бромною водою |
не взаємодіють |
знебарвлюють бромну воду |
не взаємодіють (розчиняють бром) |
Викладач звертає увагу, що для насичених і ароматичних сполук характерні реакції заміщення, а для ненасичених – реакції приєднання.
3. Генетичний зв'язок класів органічних сполук
Тренувальні вправи.
1


про публікацію авторської розробки
Додати розробку