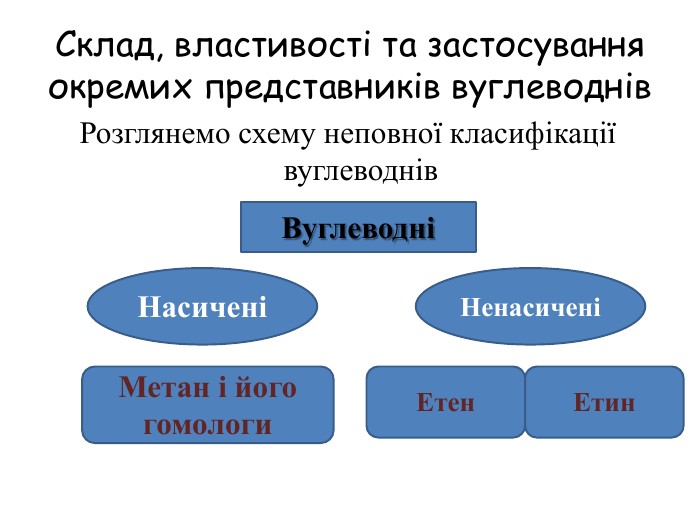
Склад, властивості, застосування окремих представників вуглеводнів (метан, етан, етен, етин).



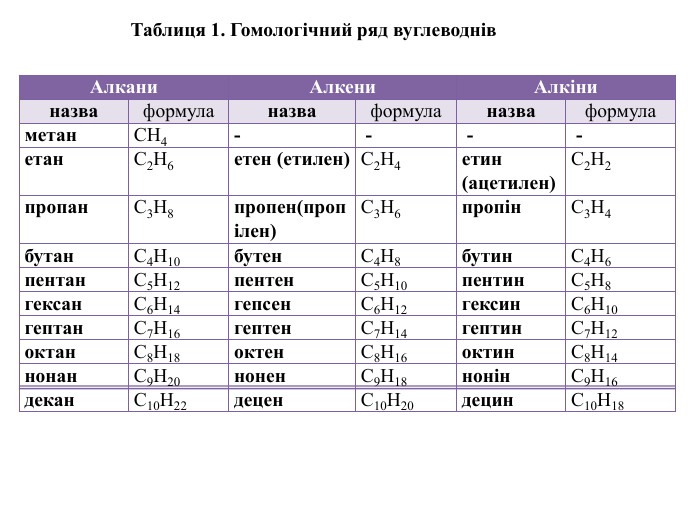











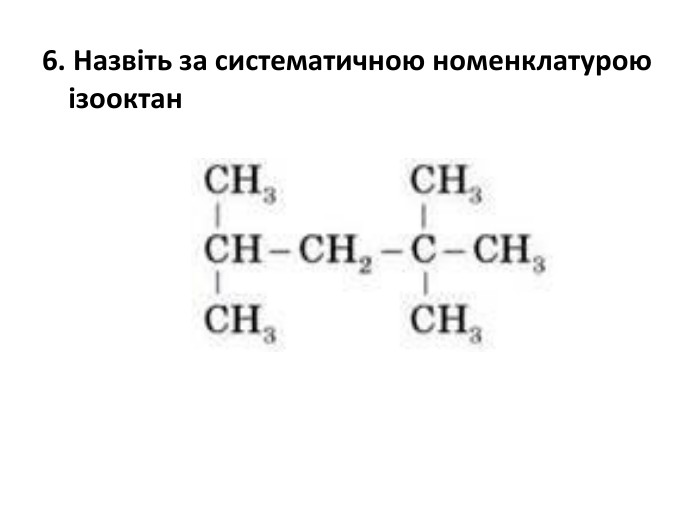





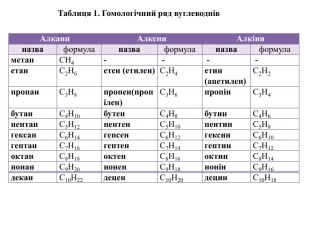
{17292 A2 E-F333-43 FB-9621-5 CBBE7 FDCDCB}Алкани. Алкени. Алкіниназваформуланазваформуланазваформуламетан. СН4- - - -етан. С2 Н6етен (етилен)С2 Н4етин (ацетилен)С2 Н2пропан. С3 Н8пропен(пропілен)С3 Н6пропін. С3 Н4бутан. С4 Н10бутен. С4 Н8бутин. С4 Н6пентан. С5 Н12пентен. С5 Н10пентин. С5 Н8гексан. С6 Н14гепсен. С6 Н12гексин. С6 Н10гептан. С7 Н16гептен. С7 Н14гептин. С7 Н12октан. С8 Н18октен. С8 Н16октин. С8 Н14нонан. С9 Н20нонен. С9 Н18нонін. С9 Н16декан. С10 Н22децен. С10 Н20децин. С10 Н18 Таблиця 1. Гомологічний ряд вуглеводнів
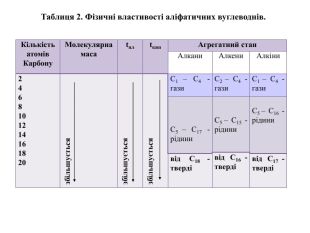
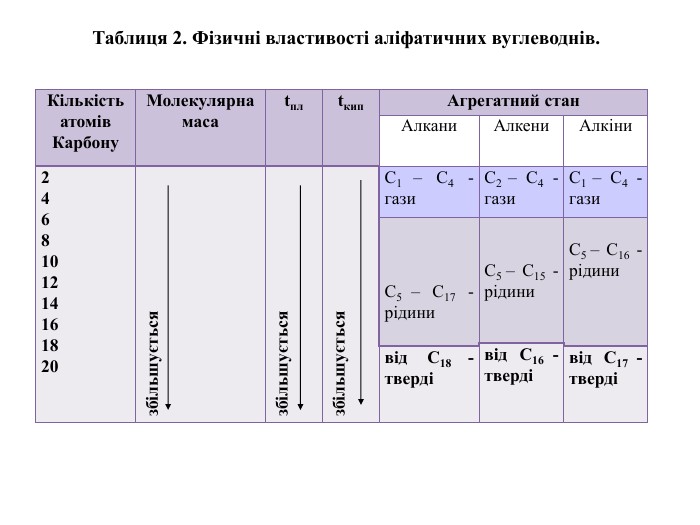
{C4 B1156 A-380 E-4 F78-BDF5-A606 A8083 BF9}Кількість атомів Карбону. Молекулярна масаtплtкип. Агрегатний стан. Алкани. Алкени. Алкіни2468101214161820збільшуєтьсязбільшуєтьсязбільшується. С1 ‒ С4 - гази. С2 ‒ С4 - гази. С1 ‒ С4 - гази С5 ‒ С17 - рідини С5 ‒ С15 - рідини С5 ‒ С16 - рідинивід С16 - твердівід С18 - твердівід С17 - твердіТаблиця 2. Фізичні властивості аліфатичних вуглеводнів.
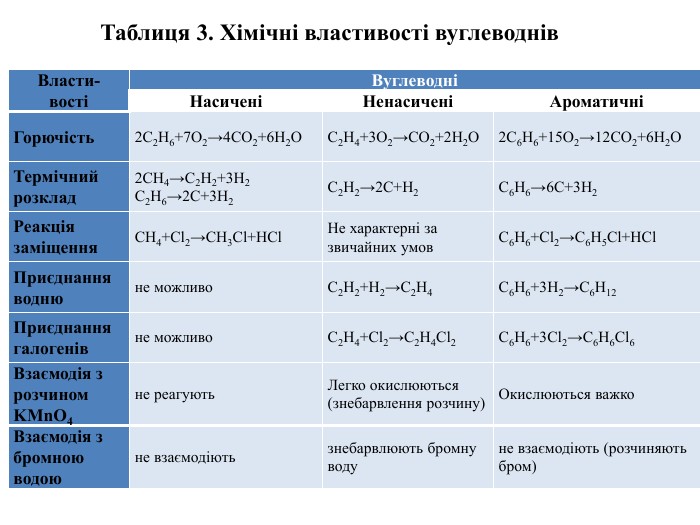
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Власти-востіВуглеводніНасиченіНенасиченіАроматичніГорючість2 С2 Н6+7 О2→4 СО2+6 Н2 ОС2 Н4+3 О2→СО2+2 Н2 О2 С6 Н6+15 О2→12 СО2+6 Н2 ОТермічний розклад2 СН4→С2 Н2+3 Н2 С2 Н6→2 С+3 Н2 С2 Н2→2 С+Н2 С6 Н6→6 С+3 Н2 Реакція заміщення. СН4+Cl2→СН3 Cl+НCl. Не характерні за звичайних умов. С6 Н6+Cl2→С6 Н5 Cl+НCl. Приєднання воднюне можливо. С2 Н2+Н2→С2 Н4 С6 Н6+3 Н2→С6 Н12 Приєднання галогенівне можливо. С2 Н4+Cl2→С2 Н4 Cl2 С6 Н6+3 Cl2→С6 Н6 Cl6 Взаємодія з рoзчином KMn. O4не реагують. Легко окислюються (знебарвлення розчину)Окислюються важко. Взаємодія з бромною водоюне взаємодіютьзнебарвлюють бромну водуне взаємодіють (розчиняють бром)Таблиця 3. Хімічні властивості вуглеводнів
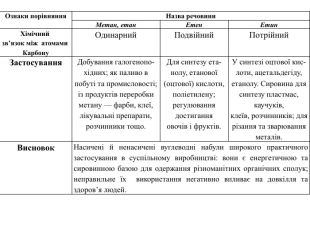
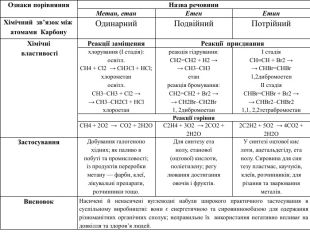
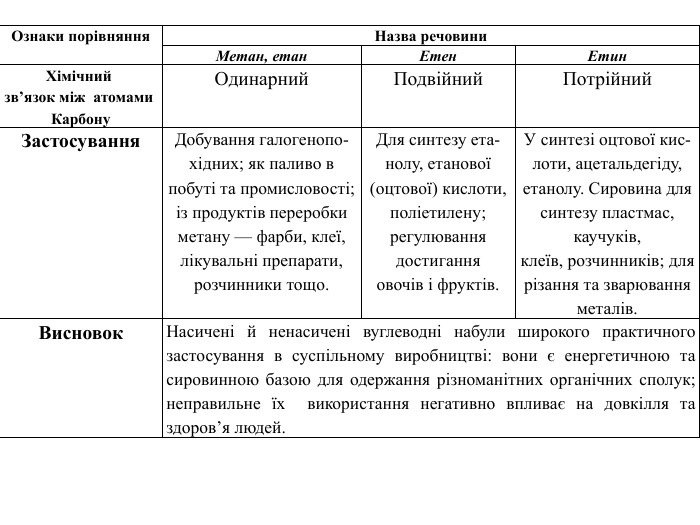
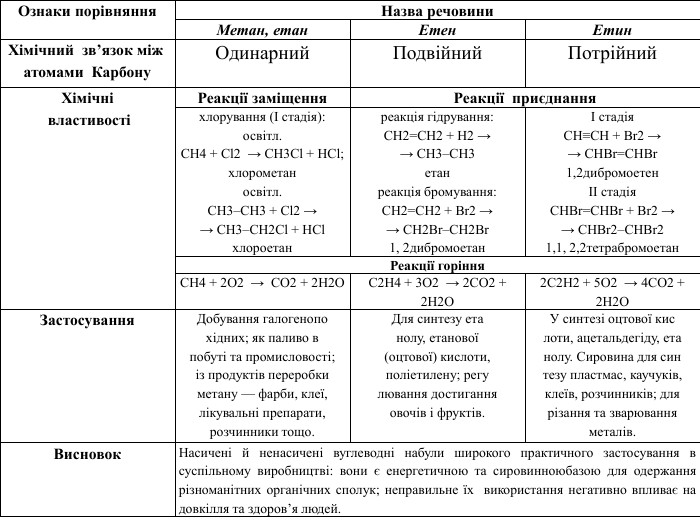
Ознаки порівняння. Назва речовини. Метан, етан. Етен. Етин. Хімічний зв’язок між атомами Карбону. Одинарний. Подвійний. Потрійний. Застосування. Добування галогенопохідних; як паливо впобуті та промисловості;із продуктів переробкиметану — фарби, клеї,лікувальні препарати,розчинники тощо. Для синтезу етанолу, етанової(оцтової) кислоти,поліетилену; регулювання достиганняовочів і фруктів. У синтезі оцтової кислоти, ацетальдегіду, етанолу. Сировина для синтезу пластмас, каучуків,клеїв, розчинників; длярізання та зварюванняметалів. Висновок. Насичені й ненасичені вуглеводні набули широкого практичного застосування в суспільному виробництві: вони є енергетичною та сировинною базою для одержання різноманітних органічних сполук; неправильне їх використання негативно впливає на довкілля та здоров’я людей.
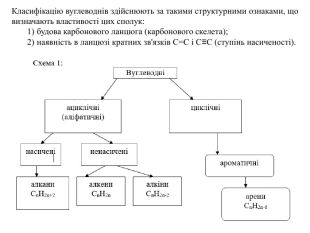
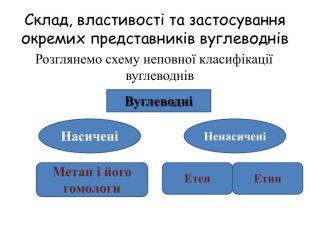
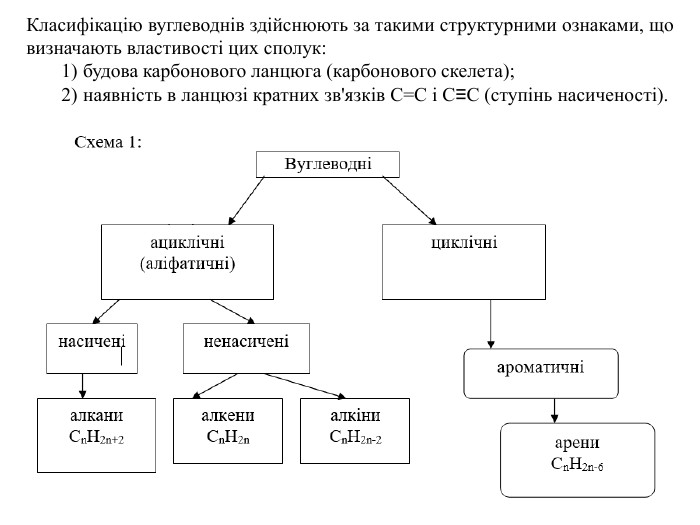
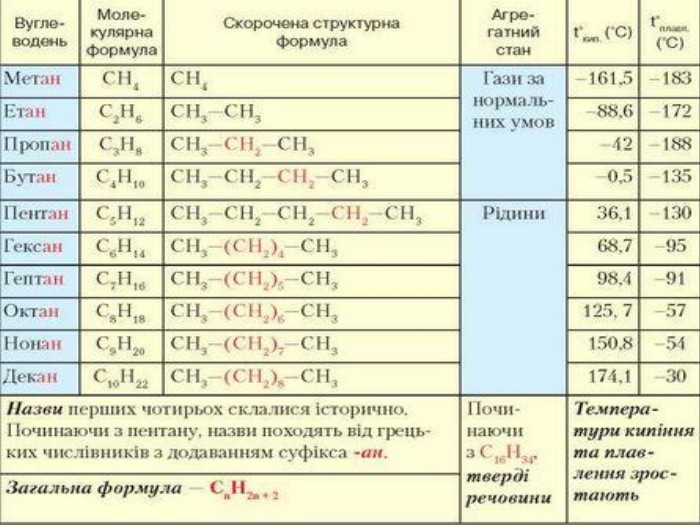
Гомологічний ряд насичених вуглеводнів, їхній склад Вивчаючи в 9 класі початкові поняття про органічні речовини, ви ознайомились із складом і будовою молекули метану та його гомологами. Вам відомо, що до складу молекули метану входять тільки два хімічні елементи — Карбон і Гідроген. Хімічна формула метану СН4, тобто молекула метану містить один атом Карбону й чотири атоми Гідрогену. Атом Карбону, утворюючи сполуку, перебуває в збудженому стані. Саме тому він може утворити чотири ковалентні зв’язки з чотирма атомами Гідрогену. Оскільки всі валентні електрони атома Карбону беруть участь в утворенні хімічних зв’язків, метан належить до насичених вуглеводнів. Водночас, завдяки специфічній властивості атомів Карбону сполучатися між собою з утворенням ланцюгів різної будови та складу, є й інші речовини, молекули яких містять Карбон і Гідроген.
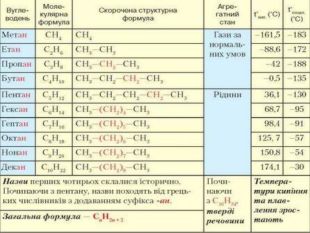
Розглянемо таблицю і пригадаємо склад, хімічні (молекулярні) формули, скорочені структурні (напівструктурні) формули, загальну формулу насичених вуглеводнів та деякі фізичні властивості насичених вуглеводнів гомологічного ряду метану, а також як змінюється їхній агрегатний стан, температури плавлення та кипіння із зростанням відносних молекулярних мас.
Ознаки порівняння. Назва речовини. Метан, етан. Етен. Етин. Хімічний зв’язок між атомами Карбону. Одинарний. Подвійний. Потрійний. Хімічні властивостіРеакції заміщення. Реакції приєднанняхлорування (І стадія):освітл. СН4 + Cl2 → СН3 Сl + HCl;хлорометаносвітл. СН3–СН3 + Cl2 →→ СН3–СН2 Сl + HClхлороетанреакція гідрування: CH2=CH2 + H2 →→ CH3–CH3етанреакція бромування: CH2=CH2 + Br2 →→ CH2 Br–CH2 Br1, 2дибромоетанІ стадія. СН≡СН + Br2 →→ CHBr=CHBr1,2дибромоетенІІ стадія. CHBr=CHBr + Br2 →→ CНBr2–CHBr21,1, 2,2тетрабромоетан. Реакції горіння. СН4 + 2 О2 → СО2 + 2 Н2 ОС2 Н4 + 3 О2 → 2 СО2 + 2 Н2 О2 С2 Н2 + 5 О2 → 4 СО2 + 2 Н2 ОЗастосування. Добування галогенопохідних; як паливо впобуті та промисловості;із продуктів переробкиметану — фарби, клеї,лікувальні препарати,розчинники тощо. Для синтезу етанолу, етанової(оцтової) кислоти,поліетилену; регулювання достиганняовочів і фруктів. У синтезі оцтової кислоти, ацетальдегіду, етанолу. Сировина для синтезу пластмас, каучуків,клеїв, розчинників; длярізання та зварюванняметалів. Висновок. Насичені й ненасичені вуглеводні набули широкого практичного застосування в суспільному виробництві: вони є енергетичною та сировинноюбазою для одержання різноманітних органічних сполук; неправильне їх використання негативно впливає на довкілля та здоров’я людей.
Висновки: Метан — найпростіший представник гомологічного ряду насичених вуглеводнів (алканів), до складу молекули якого входять один атом Карбону й чотири атоми Гідрогену. Метан утворює гомологічний ряд насичених вуглеводнів, у якому кожний наступний член цього ряду різниться за складом від попереднього на групу атомів –СН2–, її називають гомологічною різницею.
У молекулах метанових вуглеводнів атоми Карбону сполучені одинарним зв’язком, а склад молекул відображає загальна формула Сn. H2n + 2. Метан, етан та інші насичені вуглеводні вступають у реакції заміщення з хлором (хлорування) за яскравого освітлення з утворенням галогенопохідних. Етен, етин — представники ненасичених вуглеводнів, у молекулах яких наявні подвійний і потрійний (кратні) зв’язки між атомами Карбону. Як ненасичені вуглеводні, вони вступають у реакції приєднання водню (гідрування) і галогенів (галогенування).
Спільною хімічною властивістю насичених (метан, етан) і ненасичених (етен, етин) вуглеводнів є реакції горіння. Насичені вуглеводні використовують для добування галогенопохідних, виготовлення лікувальних препаратів, полімерів, як паливо, розчинники тощо. Ненасичені (етен, етин) вуглеводні теж набули широкого застосування, насамперед в органічному синтезі. етен пришвидшує достигання овочів і фруктів, етин використовують для різання та зварювання металів.
1. Застосування алканів Насичені вуглеводні широко використовуються в найрізноманітніших сферах життя й діяльності людини. Газоподібні алкани (метан і пропан-бутанова суміш) використовуються як цінне паливо. Рідкі вуглеводні становлять значну частку в моторних і ракетних паливах і використовуються як розчинники. Вазелінове масло (суміш рідких вуглеводнів із числом атомів Карбону до 15) — прозора рідина без запаху й смаку, використовується в медицині, парфумерії та косметиці. Парафін— біла тверда маса без запаху й смаку— застосовується для виготовлення свічок, голівок сірників і пакувального паперу, для теплових процедур у медицині та ін. У сучасній нафтохімічній промисловості насичені вуглеводні є базою для одержання різноманітних органічних сполук, важливою сировиною в процесах одержання напівфабрикатів для виробництва пластмас, каучуків, синтетичних волокон, мийних засобів і багатьох інших речовин. Нормальні насичені вуглеводні середньої молекулярної маси використовуються як поживний субстрат у мікробіологічному синтезі білка з нафти. Велике значення мають галогенопохідні алканів, що використовуються як розчинники, холодоагенти й сировина для подальших синтезів.
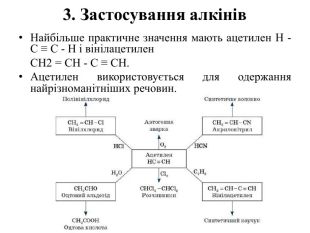
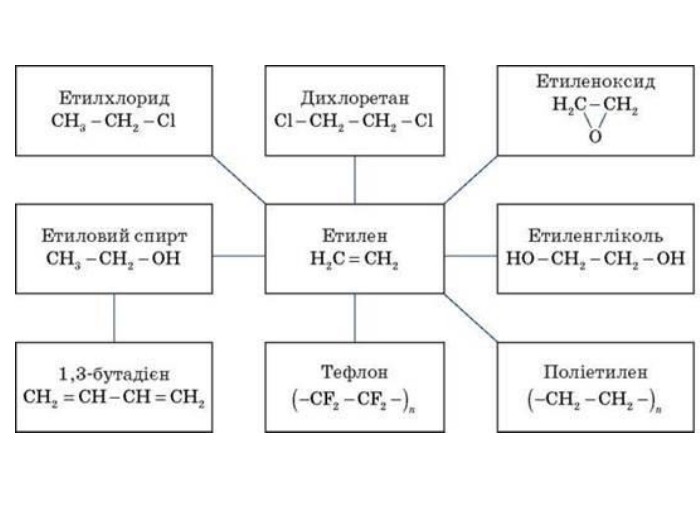
2. Застосування алкенів. Алкени застосовуються як вихідні продукти у виробництві полімерних матеріалів (пластмас, каучуків, плівок) та інших органічних речовин. Етилен (етен) Н2 С = СН2 використовується для одержання поліетилену, політетрафлуоретилену (тефлону), етилового спирту, оцтового альдегіду, галогенопохідних і багатьох інших органічних сполук. Застосовується як засіб для прискореного дозрівання фруктів. Пропілен (пропен) Н2 С = СН2 - СН3 і бутилени (1-бутен і 2-бутен) використовуються для одержання спиртів і полімерів.Ізобутилен (2-метилпропен) Н2 С = С(СН3)2 застосовується у виробництві синтетичного каучуку.


про публікацію авторської розробки
Додати розробку