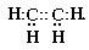Тема: Алкени. Етиленові вуглеводні. Молекулярні та структурні формули, ізомерія, фізичні властивості, хімічні властивості. Застосування.
УРОК № 4
Тема: Алкени. Етиленові вуглеводні. Молекулярні та структурні формули, ізомерія, фізичні властивості, хімічні властивості. Застосування.
Мета: формувати знання учнів про гомологічний ряди алкенів на прикладі етилену; ознайомити учнів з природою кратного зв’язку, ізомерією за місцем положення кратного зв’язку і між класовою ізомерією; удосконалювати навички і вміння складати структурні формули і давати їм назви. Формувати навички й уміння складати рівняння хімічних реакцій.
Обладнання: таблиці «Будова алкенів», «Типи гібридизації», шаростержневі моделі, мультимедійна презентація до уроку.
Тип уроку: урок вивчення нового матеріалу.
Хід уроку
І. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Уже понад місяць триває наша подорож країною органічних сполук. Ви ознайомилися з класом насичених вуглеводнів і впевнилися, що в країні органічних сполук можна легко заблукати, якщо не знаєш такі поняття, як ізомери, гомологи, номенклатура. Тому кожен із вас має підтвердити свою спроможність та отримати дозвіл на подальшу подорож країною органічних речовин.
- Перевірка домашнього завдання
Гра «Так, ні»
- Алкани відносяться до хімічно активних речовин. (ні)
- Наявність в молекулах алканів лише одинарних (простих) зв’язків обумовлює особливості хімічних властивостей алканів. (так)
- Під дією метану фіолетовий розчин калій перманганату знебарвлюється. (ні)
- Всі алкани горять, вивільняючи значну кількість теплоти, реакції горіння – це екзотермічні реакції. (так)
- Реакція С2Н6 + Cl2 → С2Н5Cl + НCl називається реакцією хлорування. (так)
- Метан та його гомологи розкладаються при сильному нагріванні без доступу кисню на водень і сажу. (так)
- Алкани можуть вступати в реакції приєднання галогенів. (ні)
- Алкани застосовуються як паливо завдяки здатності вступати в реакції термічного розкладу. (ні)
- Якщо через розчин брому, що має бурий колір, пропустити метан, то розчин знебарвиться. (ні)
- Гомологи метану С5-С11 є основою пального для автомобільних двигунів. (так)
ІІ. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Вуглеводні містять Гідроген і Карбон. Якщо речовина має склад СnH2n+2, то це алкан (СН4, С2Н6…)
А чи можна віднести до алканів речовину С2Н4? Чому? Ця речовина належать до іншого гомологічного ряду – алкенів.
Завдання уроку: познайомимося з алкенами. Навчимося складати їх формули, називати, описувати особливості будови. Розглянемо типи ізомерії характерні для ненасичених вуглеводнів та їхні хімічні властивості.
План уроку:
- Гомологічний ряд алкенів.
- Будова молекул алкенів.
- Порівняння будови алканів, алкенів.
- Види ізомерії.
- Фізичні властивості етилену.
- Хімічні властивості алкенів.
- Добування етилену.
ІІІ. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
- Гомологічний ряд алкенів
Алкени (або етиленові вуглеводні) – вуглеводні із загальною формулою СnН2n, в молекулах яких між атомами Карбону є один подвійний зв’язок.
Щоб дати назву алкенам, у назві відповідного алкану суфікс -ан замінюють на
-ен.
- Заповнити таблицю «Гомологічний ряд вуглеводнів»
Учні під керівництвом вчителя заповнюють таблицю та дають назву вуглеводням.
|
Алкани СnН2n +2 |
Алкени СnН2n |
|
СН4 метан С2Н6 етан С3 С4 С5 і т.д. |
─ С2Н4 етен (етилен) |
Чому немає алкенів з одним атомом Карбону?
- Будова молекули етилену
|
Ознака |
Етилен (алкен) |
|
Особливості будови |
Має 1 подвійний зв’язок С=С |
|
Молекулярна формула |
С2Н4 |
|
Електронна формула |
|
|
Структурна формула |
Н Н |
- Порівняння будови алканів, алкенів
Заповнити таблицю «Порівняння будови алканів, алкенів» під час пояснення, використовуючи мультимедійну презентацію та власні спостереження під час виконання лабораторного досліду.
Лабораторний дослід «Складання молекул моделей вуглеводнів»
Мета: скласти моделі молекул етану, етену порівняти будову і міцність зв’язку між атомами Карбону.
- Складіть моделі молекул етану, етену.
- Зробіть висновок про відмінність в будові й міцності зв’язків у цих молекулах.
- Атоми Карбону в молекулі етилену перебувають у стані sp2-гiбридизації, тобто в гібридизації беруть участь одна s- і дві р-орбіталі.
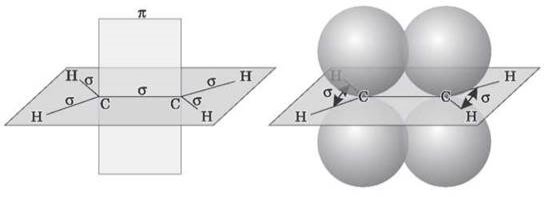
- У результаті кожен атом Карбону має три гібридні sp2-орбіталі, осі яких перебувають в одній площині під кутом 120° відносно одна одної, і одну негібридну гантелеподібну р-орбіталь, вісь якої розташована під прямим кутом до площини осей трьох sp2-орбіталей. Одна з трьох гібридних орбіталей атома Карбону перекривається з подібною орбіталлю іншого атома Карбону, утворюючи a-зв’язок.
- Кожна з решти гібридних орбіталей атомів Карбону перекривається із s-орбіталлю атомів Гідрогену, приводячи до утворення в тій самій площині чотирьох σ-зв’язків C-H. Дві негібридні р-орбіталі атомів Карбону взаємно перекриваються й утворюють п-зв’язок, максимальна густина якого розташована перпендикулярно площині a-зв’язків. Отже, подвійний зв’язок алкенів являє собою поєднання σ- і п-зв’язків.
- п-зв’язок менш міцний, ніж σ-зв’язок, оскільки р-орбіталі з паралельними осями перекриваються значно менше, ніж у разі утворення тими самим р-орбіталями та s-орбіталями σ-зв’язку (перекривання здійснюється по осі орбіталей). У зв’язку з цим п-зв’язок легко розривається й переходить у два нові σ-зв’язки з допомогою приєднання в місці подвійного зв’язку двох атомів або груп атомів реагентів. Інакше кажучи, для алкенів найбільш типовими є реакції приєднання. У реакціях приєднання подвійний зв’язок є донором електронів, тому для алкенів характерні реакції електрофільного приєднання. Розглянемо модель молекули етилену.
- Який тип гібридизації атомів Карбону спостерігається в молекулі етилену?
- Пропонуємо учням фрагмент медіафільму про гібридизацію електронів і зв’язки в молекулах етану, етену.
|
|
Алкани (етан)
|
Алкени (етен)
|
|
1.Структурні формули
|
Н Н | | Н – С - С – Н | | Н Н |
Н Н |
|
2.Тип гібридизації в атомах С |
SP3 |
SP2 |
|
3.Кількість гібридних хмар |
4 |
3 |
|
4.Кут між осями гібридних хмар |
109,5º (109,28')
|
120º
|
|
5.Зв’зки між атомами С |
Лише σ зв’язки |
1 σ і 1 π |
|
6.Відстань між атомами С |
0,154 нм |
0,134 нм |
- Види ізомерії
- Ізомерія карбонового ланцюга.
С4Н8
1 2 3 4
СН2 = СН – СН2 – СН3 1-бутен
1 2 3
СН2 = С– СН3 2-метилпропен
|
СН3
- Ізомерія положення кратного зв’язку.
С4Н8
1 2 3 4
СН2 = СН – СН2 – СН3 1-бутен
1 2 3 4
СН3 СН = СН – СН3 2-бутен
- Міжкласова ізомерія.
Алкени ізомерні циклоалканам.
С3Н6
СН2 = СН – СН3 пропен
![]() СН2
СН2
Н2С СН2 циклопропан (циклоалкан)
- Просторова ізомерія (цис – і транс -).
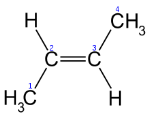
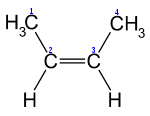
транс-2-бутен цис-2-бутен
- Фізичні властивості етилену
- Газ – прозорий. Безбарвний.
- Слабкий солодкуватий запах.
- Малорозчинний у воді.
- Легший за повітря: М(С2Н4) = 28 г/моль
М(повітря) = 29 г/моль
- Хімічні властивості алкенів.
- Реакції окиснення
1) Горіння або повне окиснення
С2Н4 + 3О2 → 2СО2 + 2Н2О + Q світне полум’я
Проблемне питання: Чому етан горить майже безбарвним полум’ям, алкени – світнім?
2∙Ar (C) 24
![]()
![]() W(C) = = = 0,80 або 80%
W(C) = = = 0,80 або 80%
Mr (C2H6) 30
2∙Ar (C) 24
![]()
![]() W(C) = = = 0,86 або 86%
W(C) = = = 0,86 або 86%
Mr (C2H4) 28
Чим більша масова частка Карбону, тим більш кіптявим буде полум’я. У етану масова частка Карбону найменша – Карбон швидко згорає (етан горить безбарвним полум’ям). У етену масова частка Карбону більша, тому перед тим як згоріти Карбон розжарюється (ми бачимо світне полум’я).
2) Часткове окиснення
КMnO4
С2Н4 + Н2О + О → CH2 – CH2
| |
OH OH
Якісна реакція на кратний зв’язок. Фіолетовий колір калій перманганату знебарвлюється.
- Реакції приєднання
- Приєднання водню (гідрування, гідрогенізація)
К
СН2 = СН2 + Н2 → СН3 – СН3
етен етан
- Приєднання галогенів (галогенування)
СН2 = СН2 + Br2 → СН2Br – СН2Br
Якісна реакція на кратний зв’язок. Бурий колір брому знебарвлюється.
- Приєднання галогеноводнів (гідрогалогенування, гідроген галогенування)
СН2 = СН2 + НBr → СН3 – СН2Br
СН2 = СН – CH3 + НBr → СН3 – СНBr – CH3
Правило Марковникова – атом гідрогену приеднується до більш гідрованого атома карбону, тоді, як атом галогену до меньш гідрованогоатома карбону.
- Приєднання води (гідратація)
СН2 = СН2 + Н2О → СН3 – СН2ОН
- Реакція полімеризації
Однією з найбільш важливих у практичному плані реакцій ненасичених сполук (або олефінів) є полімеризація. Реакцією полімеризації називається процес утворення високомолекулярної сполуки (полімеру) шляхом з’єднання одна з одною молекул вихідної низькомолекулярної сполуки (мономера). Під час полімеризації подвійні зв’язки в молекулах вихідної ненасиченої сполуки «розкриваються», і за рахунок вільних валентностей, що утворюються, ці молекули з’єднуються одна з одною.
nCH2 = CH2 → (CH2 – CH2)n
етилен поліетилен
- Добування етилену
- Дегідрування алканів (відщеплення водню)
С2Н6 → С2Н4 + Н2
- Етилен добувають нагріванням етилового спирту з Н2SO4 конц – дегідратація
Н2SO4
С2Н5ОН → С2Н4 + Н2O
- Застосування алкенів
Алкени широко використовуються в промисловості як вихідні речовини для одержання розчинників (спиртів, дихлоретану, естери гліколей тощо), полімерів (поліетилену, полівінілхлориду, поліізобутилену та ін.), а також багатьох інших дуже важливих продуктів.
Етилен (етен) H2C=CH2 використовується для одержання поліетилену, політетрафлуоретилену (тефлону), етилового спирту, оцтового альдегіду, галогенопохідних і багатьох інших органічних сполук.
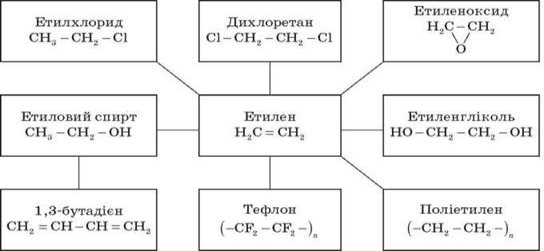
Застосовується як засіб для прискореного дозрівання фруктів.
Пропілен (пропен) H2C = CH2 CH3 і бутилени (бутен-1 і бутен-2) використовуються для одержання спиртів і полімерів.
Ізобутілен (2-метилпропен) H2C = C(CH3)2 застосовується у виробництві синтетичного каучуку.
IV.ЗАКРІПЛЕННЯ НАБУТИХ ЗНАНЬ
(Фронтальна бесіда, виконання вправ і задач)
- Вам дано дві речовини. Одна з них етан, а інша – етилен. Запропонуйте, як можна розпізнати ці речовини.
- Перелічіть, які реакції характерні для ненасичених вуглеводнів.
- «Мозковий штурм». Чому для насичених вуглеводнів притаманна здатність вступити в реакції заміщення, а для ненасичених – приєднання?
- Тест – контроль (на екрані мультимедійної дошки)
- Серед наведених реакцій вкажіть реакцію гідрування:
а) С3Н6 + НСl →; в) С3Н6 + Н2О →;
б) С3Н6 + Н2 →; г) С3Н6 + Br2 →.
- Серед наведених реакцій вкажіть реакцію галогенування:
а) СН2 = СН2 + Cl2 →; в) СН2 = СН2 + НСl →;
б) СН2 = СН2 + О2 →; г) СН2 = СН2 + Н2 →.
- Серед наведених реакцій вкажіть реакцію гідрогенгалогенування:
а) СН4 + Cl2 →;
б) С2Н4 + О2 →;
в) СН2 = СН2 + НСl →.
- Якими речовинами можна скористатися, щоб виявити сполуки з кратними зв’язками:
а) Н2; б) Br2; в) КМпО4; г) НСl.
-
Бесіда
- Чим подібні етилен і етан за складом?
- Чим відмінні етилен і етан за складом?
- Складіть молекулярні формули алкену і алкану, що містять по п’ять атомів Карбону. Напишіть структурні формули можливих ізомерів.
- Напишіть структурні формули речовин:
а) 2-метилпент-1-ен.
б) 3-метилпентан.
V. ДОМАШНЄ ЗАВДАННЯ
Опрацювати параграф.
Для речовини СН2 = СН СН2 СН2 СН3 написати 2 гомолога і 2 ізомера. (для бажаючих)


про публікацію авторської розробки
Додати розробку