Тема: Розв’язання задач на виведення формули органічної сполуки за даними про масу та об’єм реагентів або продуктів реакції.
Урок № 7
Тема: Розв’язання задач на виведення формули органічної сполуки за даними про масу та об’єм реагентів або продуктів реакції.
Мета: сформувати вміння розв’язувати задачі на встановлення формули речовини за даними про реагенти та продукти реакції, розвивати аналітичне та логічне мислення, використання математичного апарату для розв’язання хімічних задач, виховувати навички самостійності в роботі, уважність та толерантність.
Тип уроку: комбінований.
Обладнання: презентація до уроку.
Очікувані результати: учень розвязує задачі на виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною, масою, об’ємом або кількістю речовини реагентів або продуктів реакції, обгрунтовуючи обраний спосіб розв’язання.
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
ІІ. ПОСТАНОВКА МЕТИ УРОКУ, ОГОЛОШЕННЯ ЗАВДАНЬ УРОКУ, МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Перевірка домашнього завдання
Технологія «Перехресне опитування»
Один учень задає спосіб отримання етилену чи ацетилену, другий учень записує рівняння на дошці.
Розв’язання задач
Експериментально встановлено, що елементарний склад газоподібної речовини така: масова частка Гідрогену 0,1429 (або 14,29%). Маса одного літру цього газу за нормальних умов дорівнює 1,25 г. Знайдіть хімічну формулу даної речовини.
ІV. РОЗВ’ЯЗАННЯ ЗАДАЧ НА ВСТАНОВЛЕННЯ ФОРМУЛИ ЗА ДАНИМИ ХІМІЧНОЇ РЕАКЦІЇ
Задача 1
Під час згоряння 10,5 г органічної речовини отримали 16,8 л вуглекислого газу (н.у.) і 13,5 г води. Густина цієї речовини за н.у. дорівнює 1,875 г/л. Визначте молекулярну формулу речовини.
Дано: Розв’язання
m (реч.) = 10,5 г Складаємо рівняння реакції
V (CO2) = 16,8 л СхНуОz + О2 → x СО2 +  Н2О
Н2О
m (H2O) = 13,5 г Якщо атомів Карбону – х, то молекул карбон (IV)
(реч.) = 1,875 г/л оксиду теж х моль, а молекул води .
Вивести формулу.
Алгоритм розвязання
- Знайти молярну масу речовини.
- Знайти кількість речовини вуглекислого газу, вона дорівнює кількості речовини атомів Карбону. Знайти кількість речовини води, кількість речовини атомів Гідрогену вдвічі більша.
- Якщо в умові надана органічна речовина, вона може мати у складі Карбон, Гідроген та Оксиген. Треба зясувати, чи є у складі молекули Оксигену. Для цього слід знайти маси атомів Карбону та Гідрогену, їх суму. Якщо вона дорівнює масі речовини в умові – Оксигену немає, якщо ні – треба знайти масу Оксигену та його кількість речовни.
- Знайти співвідношення між атомами та скласти простішу формулу.
- За даними про густину або відносну густину знайти істинну молекулярну масу.
- Порівняти масу простішої формули й істинної та знайти істинну формулу.
Розвязання.
Знаходимо молярну масу речовини і її кількість речовини:
- М (речовини ) = Vm = 1,875 г/л 22,4 л/моль = 42 г/моль.
n = ![]() = = 0,25 моль.
= = 0,25 моль.
-
Знайдемо кількості речовини С, Н за формулами: n =
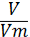 або n =
або n = 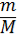 .
.
n(C) = n(CO2) = ![]() =
= ![]() = 0,75 моль.
= 0,75 моль.
n(H) = 2 n(H2O) = 2 ![]() =
= 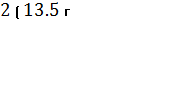 = 1,5 моль.
= 1,5 моль.
- Визначимо наявність Оксигену в складі речовини:
m(C) = n(C) M(C) = 0,75 моль 12 г/моль = 9 г.
m(H) = n(H) M(H) = 1,5 моль 1 г/моль = 1,5 г.
m(O) = m(речовини) (m(C) + m(H)) = 10,5 г (9 г +1,5 г) = 0 г, отже, Оксиген відсутній, і це вуглеводень - СхНу.
- Знаходимо формулу. n(CхНу) : n(C) : n(H) = 0,75 : 1,5 = 1 : 2 (до цілих чисел прийшли шляхом ділення всіх чисел не меншк з них, тобто на 0,75). Простіша формула СН2. Молярна маса простішої формули – 14 г/моль, а істинної – 42 г/моль. Вона більша в 3 рази, отже, кількість атомів у молекулі треба збільшити в 3 рази. Таким чином, шукана формула С3Н6.
Слово вчителя.
Пригадайте, як знайти відносну густинуодного газу за іншім.
DO2 = ![]() =
= ![]() . DН2 =
. DН2 = ![]() =
= ![]() .
.
Dповітря = 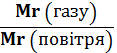 =
= ![]() .
.
Задача 2
У результаті спалювання 9,8 г вуглеводню одержали 15,68 л вуглекислого газу й 12,6 г води. Густина його пари за азотом дорівнює 3,5. Визначте формулу вуглеводню й напишіть два гомологи. Дайте їм назви.
Дано: Розв’язання:
![]() m(реч.) = 9,8 г 1) Обчислюємо відносну молекулярну масу речовини: V (CO2) = 15,68 л М (реч.) = D М (N2). М (N2) = 28 г/моль
m(реч.) = 9,8 г 1) Обчислюємо відносну молекулярну масу речовини: V (CO2) = 15,68 л М (реч.) = D М (N2). М (N2) = 28 г/моль
m (H2O) = 12,6 г М (реч.) = 3,5 28 = 98 (г/моль).
![]() DN2 = 3,5 2) Скільки грамів вуглецю в 15,68 л вуглекислого газу?
DN2 = 3,5 2) Скільки грамів вуглецю в 15,68 л вуглекислого газу?
Формула - ? m(C) = ![]() = 8,4 (г), або Y(CO2) =
= 8,4 (г), або Y(CO2) = ![]() = 0,7 (моль).
= 0,7 (моль).
Гомологи - ? m(C) = 0,7 12 = 8,4 (г)
- Скільки г водню у 12,6 г Н2О?
Y(Н2O) = ![]() = 0,7 (моль).
= 0,7 (моль).
m(H) = 0,7 2 = 1,4 (г)
- Скільки атомів Карбону й Гідрогену міститься в молекулі?
С : Н = ![]() :
: ![]() = 0,7 : 1,4 = 1 : 2.
= 0,7 : 1,4 = 1 : 2.
М (СН2) = 14 г/моль.
- Істинна формула:
![]() = 7, тобто С7Н14 – гептен
= 7, тобто С7Н14 – гептен
Гомологи:
- СН3 СН2 СН = СН СН2 СН2 СН3
3-гептен
- СН3 СН2 СН = СН СН2 СН3
3-гексен
Задача 3
Спалили 6,5 г вуглеводню. Добули 11,2 л карбон (IV) оксиду (н.у.) і 4,5 г води. Відносна густина вуглеводню за воднем дорівнює 13. Визначте формулу вуглеводню.
Дано:
![]() m(хНу) = 6,5 г 1) Знаходимо кількість речовини СхНу; СО2; Н2О.
m(хНу) = 6,5 г 1) Знаходимо кількість речовини СхНу; СО2; Н2О.
V(CO2) = 11,2 л V(СхНу) = ![]() М(СхНу) = 213 = 26 г/моль.
М(СхНу) = 213 = 26 г/моль.
m(H2O) = 4,5 г V(СхНу) = ![]() = 0,25 моль.
= 0,25 моль.
![]() DH2 = 13 V(CO2) =
DH2 = 13 V(CO2) = ![]()
Формула - ? V(CO2) = ![]() = 0,5 моль.
= 0,5 моль.
V(Н2O) = ![]()
М(Н2O) = 18 г/моль.
V(Н2O) = ![]() = 0,25 моль.
= 0,25 моль.
Ділимо на найменше число.
(СхНу)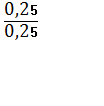 :
: ![]() =
= ![]() = 1 : 2 : 1
= 1 : 2 : 1
Підставляємо ці числа у рівняння:
2) СхНу + О2 = 2СО2 + 1Н2О.
Речовина містить С2Н2.
V. ПІДБИТТЯ ПІДСУМКІВ УРОКУ. ОЦІНЮВАННЯ ЗНАНЬ
VІ. ДОМАШНЄ ЗАВДАННЯ
1. Опрацюйте параграф.
2. Розв’яжіть задачу.
Після згорянння речовини масою 4,25 г утворилися оксид Карбону (ІV) масою 13,2 г і вода масою 5,85 г. Відносна густина парів цієї речовини за повітрям дорівнює 5,862. Визначте формулу речовини.
-
Дякую Вам


про публікацію авторської розробки
Додати розробку
