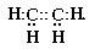Тема: Алкіни. Гомологічний ряд етину, загальна формула алкінів. Структурна ізомерія, номенклатура алкінів. Хімічні властивості. Добування та застосуваня алкінів.
УРОК № 5
Тема: Алкіни. Гомологічний ряд етину, загальна формула алкінів. Структурна ізомерія, номенклатура алкінів. Хімічні властивості. Добування та застосуваня алкінів.
Мета: формувати в учнів знання про гомологічні ряди алкінів на прикладі ацетилену; ознайомити учнів з природою кратного зв’язку на прикладі потрійного зв’язку, новими видами ізомерії ізомерією положення кратного зв’язку, міжкласовою ізомерією; розвивати навички й уміння складати структурні формули й називати органічні сполуки на прикладі гомологічного ряду алкінів; ознайомити з фізичними властивостями ацетилену; показати зв’язок будови та властивостей, зумовлених наявністю в молекулі алкінів потрійного зв’язку; познайомити учнів з хімічними властивостями алкінів на прикладі ацетилену: реакції окиснення і приєднання. Формувати навички й уміння складати рівняння хімічних реакцій.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальна робота, навчальна лекція, демонстраційний експеримент, робота з довідковою літературою.
Демонстрація: Одержання етину карбідним способом.
Обладнання: схема будови ацетилену, куле-стрижневі моделі ацетилену, фрагмент медіа-фільму «sp-гібридизація електронів у атомі Карбону».
Хід уроку
І. ОРГАНІЗАЦІЯ КЛАСУ
ІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Вправа «Мозковий штурм»
- Упізнай речовину за описом:
а) Газ, легший за повітря, без запаху, не розчинний у воді, спричиняє аварії на шахтах, є майже в кожного вдома. (метан)
б) Густа біла маса, знебарвлює розчин бромної води, після висушування на сонці стає еластичною речовиною, має відношення до гуми, її добувають у південній півкулі з рослини гевеї. (каучук)
в) Газ, без запаху. Ненасичена речовина, використовується для найпоширенішого матеріалу, що не руйнується в природі майже 200 років, використовується для підвтщення врожайності томатів. (етен)
2. Який термін зайвий і чому? (робота в парах)
а) Алкани б) Алкени
Циклоалкани Алкадієни
Алкени Циклоалкани
3. Знайдіть відповідність:
бутан
sp3 етилен
sp2 циклопропан
ізопрен
ІІІ. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Алкіни (або ацетиленові вуглеводні) – вуглеводні із загальною формулою
СnН2n-2, в молекулах яких між атомами Карбону є один потрійний зв’язок.
Щоб дати назву алкінам, у назві відповідного алкану суфікс -ан замінюють на -ин або -ін.
- Заповнити таблицю «Гомологічні ряди вуглеводнів»
|
Алкани СnН2n +2 |
Алкени СnН2n |
Алкіни СnН2n ─2 |
|
СН4 метан С2Н6 етан С3 С4 С5 і т.д. |
─ С2Н4 етен (етилен) |
─ С2Н2 етин (ацетилен) |
Чому немає алкенів і алкінів з одним атомом Карбону?
- Будова молекул етилену і ацетилену
|
Ознака |
Етилен (алкен) |
Ацетилен (алкін) |
|
Особливості будови |
Має 1 подвійний зв’язок С = С |
Має 1 потрійний зв’язок -С ≡ С- |
|
Молекулярна формула |
С2Н4 |
С2Н2 |
|
Електронна формула |
|
Н:С:::С:Н
|
|
Структурна формула |
Н Н |
Н – С ≡ С Н |
- Порівняння будови алканів, алкенів, алкінів.
Заповнити таблицю «Порівняння будови алканів, алкенів, алкінів» під час пояснення, використовуючи мультимедійну презентацію та власні спостереження під час виконання лабораторного досліду.
Лабораторний дослід «Складання молекул моделей вуглеводнів»
Мета: скласти моделі молекул етану, етену, ацетилену, порівняти будову і міцність зв’язку між атомами Карбону.
- Складіть моделі молекул етану, етену, ацетилену.
- Зробіть висновок про відмінність в будові й міцності зв’язків у цих молекулах.
|
|
Алкани (етан) |
Алкени (етен) |
Алкіни (етин) |
|
1. Структурні формули
|
Н Н | | Н – С С – Н | | Н Н |
Н Н |
Н – С ≡ С Н
|
|
2.Тип гібридизації в атомах С |
SP3
|
SP2
|
SP
|
|
3.Кількість гібридних хмар |
4
|
3
|
2
|
|
4.Кут між осями гібридних хмар |
109,5º (109,28)
|
120º
|
180º
|
|
5.Зв’зки між атомами С |
Лише σ зв’язки
|
1 σ і 1 π
|
1 σ і 2 π
|
|
6.Відстань між атомами С |
0,154 нм
|
0,134 нм
|
0,120 нм
|
Атоми Карбону в молекулі ацетилену перебувають у стані sp-гібридизації. Це означає, що кожен атом Карбону має дві гібридні sp-орбіталі, осі яких розташовані на одній лінії під кутом 180° одна до одної, а дві p-орбіталі залишаються негібридними.
![]()
sp-гібридні орбіталі двох атомів Карбону в стані, що передує утворенню потрійного зв’язку і зв’язків С H
По одній із двох гібридних орбіталей кожного атома Карбону взаємно перекриваються, приводячи до утворення σ-зв’язку між атомами Карбону. Кожна з решти гібридних орбіталей перекривається із s-орбіталлю атома Гідрогену, утворюючи σ-зв’язок C H.
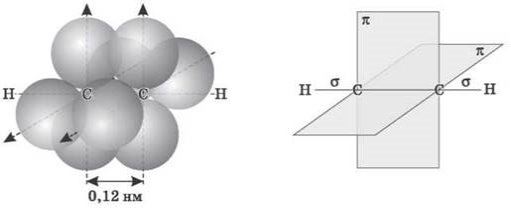
Схематичне зображення будови молекули ацетилену
(ядра атомів Карбону й Гідрогену на одній прямій, два п-зв’язки між атомами Карбону перебувають у двох взаємно перпендикулярних площинах).
Дві негібридні p-орбіталі кожного атома Карбону, розташовані перпендикулярно одна одній і перпендикулярно напрямку σ-зв’язків, взаємно перекриваються й утворюють два п-зв’язки. Отже, потрійний зв’язок характеризується сполученням одного σ- і двох п-зв’язків.
Для алкінів характерними є всі реакції приєднання, властиві алкенам, однак у них після приєднання першої молекули реагенту залишається ще один п-зв’язок (алкін перетворюється на алкен), що може знову вступати в реакцію приєднання з іншою молекулою реагенту. Крім того, «незаміщені» алкіни проявляють кислотні властивості, зумовлені відщепленням протона від атома Карбону, що складає потрійний зв’язок (![]() C H).
C H).
- Види ізомерії
- Ізомерія карбонового ланцюга
С5Н8
СН ≡ С – СН2 – СН2 – СН3 1-пентин
1 2 3 4
СН ≡ С – СН – СН3 3-метил-1-бутин
|
СН3
- Ізомерія положення кратного зв’зку
С4Н6
1 2 3 4
СН ≡ С – СН2 – СН3 1-бутин
1 2 3 4
СН3 С ≡ С – СН3 2-бутин
- Міжкласова ізомерія
Алкіни ізомерні алкодієнам.
С4Н6
1 2 3 4
СН ≡ С – СН2 – СН3 1-бутин
1 2 3 4
СН2 = СН – СН = СН2 1,3-бутадієн (дієнові вуглеводні)
- Фізичні властивості ацетилену
Газ – прозорий, безбарвний
Майже без запаху
Малорозчинні у воді
Легший за повітря:
М (С2Н2) = 26 г/моль
М (повітря) = 29 г/моль
- Хімічні властивості алкінів
- Реакції окиснення
1) Горіння або повне окиснення
2С2Н2 + 5О2 → 4СО2 + 2Н2О +Q кіптяве полум’я
Проблемне питання: Чому етан горить майже безбарвним полум’ям, алкени – світнім, а алкіни – кіптявим?
2∙Ar (C) 24
![]()
![]() W(C) = = = 0,80 або 80%
W(C) = = = 0,80 або 80%
Mr (C2H6) 30
2∙Ar (C) 24
![]()
![]() W(C) = = = 0,86 або 86%
W(C) = = = 0,86 або 86%
Mr (C2H4) 28
2∙Ar (C) 24
![]()
![]() W(C) = = = 0,92 або 92%
W(C) = = = 0,92 або 92%
Mr (C2H2) 26
Чим більша масова частка Карбону, тим більш кіптявим буде полум’я. У етану масова частка Карбону найменша – Карбон швидко згорає (етан горить безбарвним полум’ям). У етену масова частка Карбону більша, тому перед тим як згоріти Карбон розжарюється (ми бачимо світне полум’я). У ацетилена масова частка Карбону найбільша, тому Карбон не весь згорає із-за нестачі кисню (ми бачимо кіптяве полум’я).
- Реакції приєднання
- Приєднання водню (гідрування, гідрогенізація)
СН ≡ СН + Н2 → СН2 = СН2
ацетилен етен
К
СН ≡ СН + 2 Н2 → СН3 – СН3
ацетилен етан
- Приєднання галогенів (галогенування)
СН ≡ СН + Br2 → СН2Br = СН2Br
СН ≡ СН + 2Br2→ СНBr2 – СНBr2
Якісна реакція на кратний зв’язок. Бурий колір брому знебарвлюється.
- Приєднання галогеноводнів (гідрогалогенування, гідрогенгалогенування)
СН ≡ СН + НBr → СН2 = СНBr
СН2 = СН2 + НBr → СН3 – СН2Br
- Добування ацетилену
- Дегідрування алканів (відщеплення водню)
С2Н6 → С2Н2 + 2Н2
- Ацетилен добувають з кальцію.
СаСО3 → СаО + СО2
СаО + 3С → СаС2 + СО
СаС2 + 2Н2О → С2Н2 + Са(ОН)2
- Ацетилен добувають термічним розкладом метану.
1500°С
2СН4 → С2Н2 + 3Н2
- Використання ацетилену
Ацетилен є вихідною речовиною для виробництва багатьох хімічних сполук: етилового спирту, оцтової кислоти, синтетичного каучуку, хлорвінілових і поліхлорвінілових пластмас.
ІV. ЗАКРІПЛЕННЯ ТА УЗАГАЛЬНЕННЯ ЗНАНЬ
Бесіда
- Чим подібні етилен і ацетилен за складом?
- Чим відмінні етилен і ацетилен за складом?
- Складіть молекулярні формули алкену і алкіну, що містять по п’ять атомів Карбону. Напишіть структурні формули можливих ізомерів.
- Напишіть структурні формули речовин:
а) 2-метил бут-1-ен;
б) 3-метилпент-1-ин.
- Визначте молекулярну формулу алкіну, якщо його відносна молекулярна маса дорівнює 82.
- Обчисліть масові частки Карбону і Гідрогену в молекулі ацетилену.
- Вкажіть тип реакції, спільний для насичених і ненасичених вуглеводнів:
а) приєднання; б) заміщення; в) горіння; г) обміну.
- Які особливості будови зумовлюють характерні властивості етилену:
а) простий (ординарний) зв’язок; в) потрійний зв’язок;
б) подвійний зв’язок; г) два подвійні зв’язки.
- Які особливості будови зумовлюють характерні властивості ацетилену:
а) простий (ординарний) зв’язок; в) потрійний зв’язок;
б) подвійний зв’язок; г) два подвійні зв’язки.
- Виберіть правильне твердження: етилен можна одержати під час…
а) взаємодії етану з хлором;
б) взаємодії ацетилену з хлороводнем;
в) дегідрування етану;
г) дегідратації етилового спирту(відщеплення Н2О).
- Виберіть правильне твердження: ацетилен можна одержати під час…
а) дегідрування пропану;
б) термічного розкладу метану;
в) дегідрування етану;
г) дегідратації етилового спирту (відщеплення Н2О).
V. ДОМАШНЄ ЗАВДАННЯ
- Опрацювати параграф.
- Здійснити перетворення:
CО2 С2Н4Cl2
↑ ↑
С → СН4 → С2Н2 → С2Н4 → С2Н6 → СО2
↓ ↓
С2Н2Br4 С2Н5Cl
-
Дякую

про публікацію авторської розробки
Додати розробку