Тема уроку КОВАЛЕНТНИЙ ЗВ’ЯЗОК. ПОЛЯРНИЙ І НЕПОЛЯРНИЙ КОВАЛЕНТНИЙ ЗВ’ЯЗОК. ЕЛЕКТРОННІ ФОРМУЛИ МОЛЕКУЛ
ПОЛЯРНИЙ І НЕПОЛЯРНИЙ КОВАЛЕНТНИЙ ЗВ’ЯЗОК.
ЕЛЕКТРОННІ ФОРМУЛИ МОЛЕКУЛ
Цілі:
- Формування ключових компетентностей:
- саморозвитку й самоосвіти — створення проблемних ситуацій;
- інформаційної — вміння робити короткий раціональний запис, робити висновки та узагальнення.
- Формування предметних компетентностей: дати поняття ковалентного зв’язку, з’ясувати механізм утворення ковалентного зв’язку, його види, дати поняття «диполь», розвивати поняття «електронегативність»; набути навичок складання електронних і структурних формул будови молекул; виховувати вміння виділяти головне, актуалізувати, конспектувати, порівнювати, зіставляти.
Обладнання: Періодична система, таблиці «Види хімічного зв’язку», «Електронегативність атомів хімічних елементів».
Тип уроку: ВНМ (О).
Форми роботи: лекція, евристична бесіда, прийом «Гронування».
ХІД УРОКУ
І. ОРГАНІЗАЦІЯ КЛАСУ
ІІ. ОГОЛОШЕННЯ ТЕМИ Й МЕТИ УРОКУ
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
На одній стороні дошки записані основні поняття теми, а на другій — запитання бесіди (можна спроектувати на екран).
- Чому виникає хімічний зв’язок?
- Що таке електронегативність?
- Як змінюється електронегативність у періодах і групах?
- Що спільного в будові атомів елементів головних підгруп?
- Що спільного в будові атомів інертних елементів?
- Чому молекули благородних газів одноатомні?
- Які ви знаєте ще гази — прості речовини? Назвіть їх формули. У чому відмінність від молекул благородних газів?
IV. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Чому молекули благородних газів одноатомні, а молекули інших газів — простих речовин — двохатомні? Як утворюються хімічні зв’язки? На ці питання ми повинні знайти відповіді на уроці.
V. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Лекція з елементами евристичної бесіди
План лекції
1) Визначення хімічного зв’язку. Його види.
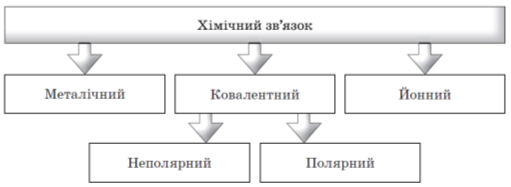
2) Поняття про ковалентний зв’язок.
3) Утворення молекули водню як приклад ковалентного неполярного зв’язку.
Електрони зовнішнього шару будемо позначати крапками й малювати навколо кожного атома хімічного елемента.
Молекула водню складається з двох атомів Гідрогену. Скільки електронів на зовнішньому рівні в атомів Гідрогену? А скільки не вистачає до завершення зовнішнього електронного шару? Під час наближення двох атомів позитивно заряджені ядра кожного з цих атомів притягують до себе електронні хмари від іншого атома. За достатнього наближення електрони утворюють спільну електронну пару, яка належить обом атомам. Звертаємо увагу учнів на таблицю й наголошуємо, що найбільша електронна густина розміщена симетрично до обох атомних ядер.
H⋅+⋅H→H⋅⋅H
Електронна формула
H−H
Структурна формула
Пояснюємо, що таке електронна та структурна формули.
4) Утворення молекули гідроген хлориду (хлороводню) як приклад ковалентного полярного зв’язку.
Скільки електронів на зовнішньому електронному рівні в атома Хлору? Скільки не вистачає до його завершення? Вчимо учнів складати електронні та структурні формули сполук з ковалентним полярним зв’язком. Звертаємо увагу на те, що найбільша електронна густина буде зміщена в бік більш електронегативного елемента.

Знову звертаємо увагу учнів на таблицю й наголошуємо, що спільна електронна пара зміщена до атома Хлору як більш електронегативного.
5) Пояснюємо, що таке частковий заряд — дельта (δ), що таке диполь. Застосовуємо таке поняття, як електронегативність.
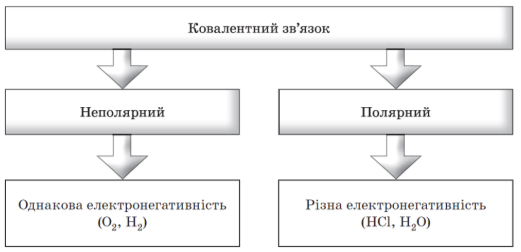
Робимо висновок про відмінність ковалентного неполярного й полярного зв’язків. Складаємо схему, наводимо приклади сполук з ковалентним неполярним і ковалентним полярним зв’язками.
VI. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
- Що таке ковалентний зв’язок?
- Який механізм утворення ковалентного зв’язку?
- Які види ковалентного зв’язку ви знаєте?
- Виберіть і запишіть речовини з ковалентним неполярним і полярним зв’язком:
O2, NH3, H2S, Br2, N2, CH4.
- Запишіть електронні та структурні формули утворення ковалентного зв’язку в молекулах хлору та гідроген флуориду.
- Що спільного й у чому полягає відмінність ковалентного неполярного й полярного зв’язків?
Отже, сьогодні на уроці ми вивчили суть ковалентного зв’язку. Ознайомилися з його видами. Навчилися складати електронні та структурні формули будови сполук з ковалентним неполярним і ковалентним полярним зв’язком. Ознайомилися з поняттям «диполь». Поглибили поняття «електронегативність».
VIII. ДОМАШНЄ ЗАВДАННЯ
Презентацію створено за допомогою комп’ютерної програми ВГ «Основа» «Електронний конструктор уроку»
© ТОВ «Видавнича група “Основа”», 2016
Джерела:
Стеценко І. В., Овчаренко І. Ю. Усі уроки хімії. 8 клас. — Х. : Вид. група «Основа», 2016. — 287, [1] с.: іл., табл., CD — (Серія «Усі уроки»).


про публікацію авторської розробки
Додати розробку
