УРОК :БУДОВА АТОМА. СКЛАД АТОМНИХ ЯДЕР. ПРОТОННЕ Й НУКЛОННЕ ЧИСЛО. НУКЛІД
УРОК :БУДОВА АТОМА. СКЛАД АТОМНИХ ЯДЕР.
ПРОТОННЕ Й НУКЛОННЕ ЧИСЛО. НУКЛІД
Цілі:
- Формування ключових компетентностей:
- саморозвитку й самоосвіти — створення проблемних ситуацій, уміння розв’язувати задачі;
- інформаційної — вміння робити короткий раціональний запис, робити висновки й узагальнення;
- полікультурної — виховання на прикладі біографій видатних людей.
- Формування предметних компетентностей: повторити будову атома, ознайомити учнів з будовою атомних ядер, дати поняття «протон», «нейтрон», «протонне», «нуклонне число»; навчитися розраховувати число протонів і нейтронів у ядрах атомів, знаходити у ПС протонне й нуклонне числа для кожного елемента, знати їхнє значення; привчати школярів відповідально ставитися до виконання завдань, бути уважними, не відволікатися від основної роботи; виховувати інтерес до вивчення хімії.
Обладнання: періодична система, таблиця «Будова атома».
Тип уроку: ВНМ(О).
Форми роботи: самостійна робота, лекція, бесіда, прийоми «Хімічна розминка — асоціативний кущ», «Гронування», «Власні приклади».
ХІД УРОКУ
І. ОРГАНІЗАЦІЯ КЛАСУ
ІІ. ОГОЛОШЕННЯ ТЕМИ Й МЕТИ УРОКУ
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
1 Хімічна розминка — асоціативний кущ
Пропонуємо учням назвати всі поняття, які пов’язані з темою «Будова Періодичної системи». Ці поняття, як звичайно, записуємо на дошці.
- Періодичний закон.
- Періодична система.
- Період.
- Види періодів.
- Група.
- Підгрупи.
- Головна підгрупа.
- Побічна підгрупа.
Доповнюємо по ходу уроку:
- ядро;
- електрон;
- протон;
- нейтрон;
- протонне число;
- нуклонне число.
У цей час декілька учнів на дошці виконують домашнє завдання.
2 Самостійна робота
Варіант І
Укажіть правильну відповідь.
1. Вищий оксид елемента з протонним числом 15 має властивості:
а) основні;
б) кислотні;
в) амфотерні.
2. Вкажіть протонні числа елементів, що мають однакову кількість електронів на зовнішньому рівні:
а) 5;
б) 21;
в) 6;
г) 7;
д) 14;
е) 8.
3. У головних підгрупах зверху вниз неметалічні властивості:
а) посилюються;
б) не змінюються;
в) послаблюються.
4. Які пари елементів мають подібні властивості:
а) N і І;
б) S і P;
в) Si і Ge.
5. Розташуйте елементи за збільшенням радіуса атома:
а) Na;
б) Cs;
в) K;
г) Li.
6. У періодах справа наліво неметалічні властивості:
а) посилюються;
б) не змінюються;
в) послаблюються.
7. Які властивості має хімічний елемент 1s22s22p63s2?
а) Основні;
б) кислотні;
в) амфотерні.
8. Закінчіть речення: «Номер періоду вказує на...».
9. Закінчіть речення: «Протонне число вказує на...».
Варіант ІІ
Укажіть правильну відповідь.
1. Вищий оксид елемента з протонним числом 11 має властивості:
а) основні;
б) кислотні;
в) амфотерні.
2. У періодах зліва направо металічні властивості:
а) посилюються;
б) послаблюються;
в) не змінюються.
3. Елемент, у якого на зовнішньому рівні 4 електрони, має протонне число:
а) 5;
б) 22;
в) 32;
г) 83.
4. Які пари хімічних елементів мають найбільш подібні властивості?
а) Na і Mg;
б) Ti і C;
в) Br і Cl.
5. Розташуйте елементи за зменшенням радіуса атома:
а) B;
б) O;
в) C;
г) N.
6. У головних підгрупах знизу вгору металічні властивості:
а) посилюються;
б) не змінюються;
в) послаблюються.
7. Які властивості має хімічний елемент 1s22s22p63s23p4?
а) Основні;
б) кислотні;
в) амфотерні.
8. Закінчіть речення: «Номер групи вказує на...».
9. Закінчіть речення: «Нуклонне число вказує на...».
IV. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Починаємо мотивацію із завдання:
Знайдіть у Періодичній системі випадки невідповідності положення елемента значенню його відносної атомної маси. Учні знаходять і вчитель пояснює, що на час відкриття періодичного закону рівень розвитку такої науки, як фізика, був низький, будова атома ще не була вивчена. Учитель розповідає про дослідження Е. Резерфорда з вивчення будови атома й пояснює, що тільки після вивчення його будови було пояснено причину періодичного повторення властивостей елементів.
V. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Розповідь учителя про дослід Е. Резерфорда, ядерну модель атома.
2. Гронування. Згадуємо з учнями будову атома та записуємо схему:
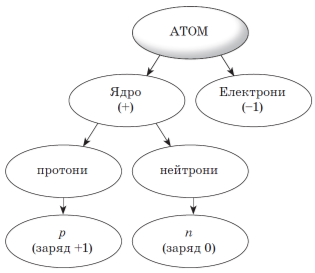
Нагадуємо, що атом електронейтральний, тому що позитивний заряд ядра атома врівноважується сумарним негативним зарядом усіх електронів.
3. Пояснюємо, що номер, під яким елемент стоїть у Періодичній системі, вказує на заряд ядра його атома. Наприклад, якщо Натрій стоїть під порядковим номером 11, то заряд ядра його атома +11; якщо Кальцій під номером 20, то й заряд ядра його атома +20 і т. д.
4. Отже, якщо атом електронейтральний, то навколо ядра рухається стільки електронів, який заряд ядра атома. Наприклад, заряд ядра атома Кальцію +20, отже, навколо ядра атома Кальцію рухається 20 електронів.
5. Пояснюємо, що ядро складається з протонів і нейтронів, даємо поняття, яка частинка є протоном, а яка нейтроном.
6. Пояснюємо, що таке протонне число й нуклонне число. Вчимо учнів знаходити в Періодичній системі протонні й нуклонні числа елементів, записувати їх.
Пояснюємо поняття і позначення «нуклід».
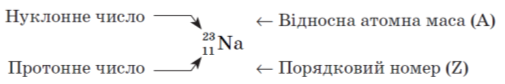
Нуклід Оксигену-16 записують як 16O.

Отже, протонне число вказує на таке:
- заряд ядра атома;
- кількість електронів;
- кількість протонів.
7. Вчимо учнів розраховувати число протонів і нейтронів у ядрах атомів за формулою
A = Z +N,
де А — нуклонне число;
Z — протонне число;
N — кількість нейтронів.
Отже, щоб розрахувати кількість нейтронів у ядрах атомів, треба від нуклонного числа відняти протонне число: N = A − Z. Наприклад, у ядрі атома Натрію буде 23 −11 = 12 нейтронів.
VI. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Прийом «Власні приклади»
1. Учитель робить на дошці запис і пропонує учням прокоментувати його й навести власні приклади.
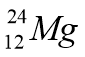
2. Вчитель розраховує кількість протонів, електронів та нейтронів у ядрі будь-якого елемента і пропонує учням навести власні приклади.
Робимо висновок, що хімічні елементи розташовані в Періодичній системі за збільшенням зарядів їхніх атомних ядер, а не за збільшенням відносної атомної маси.
VIII. ДОМАШНЄ ЗАВДАННЯ
МАТЕРІАЛИ ДО УРОКУ
- Історична довідка про Е. Резерфорда
Англійський фізик Ернест Резерфорд народився в Новій Зеландії, неподалік від м. Нельсона. Він був одним із 12 дітей колісного майстра й будівельника Джеймса Резерфорда, шотландця за походженням, і Марти (Томпсон) Резерфорд, шкільної вчительки з Англії. Спочатку Резерфорд відвідував початкову й середню місцеві школи, а потім став стипендіатом Нельсон-колледжу, приватної вищої школи, де виявив себе талановитим студентом, особливо в математиці.

У коледжі на Резерфорда дуже вплинули його вчителі: викладач фізики й хімії Е. У. Бікертон і математик Дж. Х. Кук. Після того як 1892 р. Резерфорду був присуджений ступінь бакалавра гуманітарних наук, він залишився в Кентербері-коледжі й продовжив свої заняття завдяки отриманій стипендії з математики. Наступного року він став магістром гуманітарних наук, краще за всіх склавши екзамени з математики й фізики. Його магістерська робота стосувалася виявлення високочастотних радіохвиль, існування яких було доведено близько десяти років тому.
1894 р. Резерфорду був присуджений ступінь бакалавра природничих наук. У Кембриджі Резерфорд працював під керівництвом англійського фізика Дж. Томсона. На Томсона справило глибоке враження проведене Резерфордом дослідження радіохвиль, і 1896 р. він запропонував спільно вивчати вплив рентгенівських променів (відкритих роком раніше Вільгельмом Рентгеном) на електричні розряди в газах. Їхня співпраця увінчалася вагомими результатами, включаючи відкриття Томсоном електрона — атомної частки, що несе негативний електричний заряд. Спираючись на свої дослідження, Томсон і Резерфорд висунули припущення, що, коли рентгенівські промені проходять через газ, вони руйнують атоми цього газу, вивільняючи однакове число позитивно й негативно заряджених часток. Ці частки вони назвали йонами. Після цієї роботи Резерфорд зайнявся вивченням атомної структури.
1898 р. Резерфорд зайняв місце професора Макгілського університету в Монреалі (Канада), де почав серію важливих експериментів, які стосувалися радіоактивного випромінювання елемента Урану. Незабаром він відкрив два види цього випромінювання: альфа-промені, що проникають тільки на коротку відстань, і бета-промені, які проникають на значно більшу відстань.
Спираючись на подальші дослідження, проведені в Макгілському університеті в 1901–1902 рр., Резерфорд і його колега Фредерік Содді виклали основні положення створеної ними теорії радіоактивності. Відповідно до цієї теорії, радіоактивність виникає тоді, коли атом відриває частку самого себе, що викидається з величезною швидкістю, і ця втрата перетворює атом одного хімічного елемента на атом іншого.
Резерфорд провів подальші експерименти для одержання результатів, які підтвердили висунуту ним теорію. 1903 р. він довів, що альфа-частинки несуть позитивний заряд. Учений був переконаний, що альфа-частинки не можна відрізнити від ядра атома Гелію.
1907 р. Резерфорд, прагнучи перебувати ближче до центра наукових досліджень, зайняв пост професора фізики в Манчестерському університеті (Англія). За допомогою Ханса Гейгера, що згодом прославився як винахідник лічильника Гейгера, Резерфорд створив у Манчестері школу з вивчення радіоактивності.
1908 р. Резерфорду була присуджена Нобелівська премія з хімії «за проведені ним дослідження в галузі розпаду елементів у хімії радіоактивних речовин».
Міркуючи над цим явищем, Резерфорд 1911 р. запропонував нову модель атома. Відповідно до його теорії, що сьогодні стала загальноприйнятою, позитивно заряджені частки зосереджені у важкому центрі атома, а негативно заряджені (електрони) перебувають на орбіті ядра, на досить великій відстані від нього. Ця модель, подібна до малюсінької моделі Сонячної системи, передбачає, що атоми складаються головним чином із порожнього простору. Широке визнання теорій Резерфорда почалося з 1913 р., коли до роботи вченого в Манчестерському університеті підключився датський фізик Нільс Бор. Бор показав, що в термінах пропонованої Резерфордом структури можуть бути пояснені загальновідомі фізичні властивості атома Гідрогену, а також атомів декількох більш важких елементів.
1900 р., під час короткої поїздки в Нову Зеландію, Резерфорд одружився з Мері Ньютон, яка народила йому дочку. Майже до кінця життя він відрізнявся міцним здоров’ям і вмер у Кембриджі 1937 р. після нетривалої хвороби. Резерфорд похований у Вестмінстерському абатстві неподалік могил Ісаака Ньютона й Чарльза Дарвіна.





про публікацію авторської розробки
Додати розробку
