Урок “Енергетичні рівні та підрівні; їх заповнення електронами в атомах елементів I-III періодів. Електронні та графічні електронні формули атомів хімічних елементів”
План-конспект уроку.
Предмет: Хімія
Клас: 8
Тема: Енергетичні рівні та підрівні; їх заповнення електронами в атомах елементів I-III періодів. Електронні та графічні електронні формули атомів хімічних елементів.
Цілі уроку: розширити уявлення учнів про будову атомів; навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I—III періодів; формувати вміння учнів визначати електронну будову атома за його положенням у періодичній системі; формувати уявлення учнів про єдину природу матеріального світу.
Очікуванні результати:учні повинні мати уявлення про будову атому, про єдину природу матеріального світу;учні повинні навчитись складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I—III періодів; учні повинні вміти визначати електронну будову атома за його положенням у періодичній системі;
Тип уроку: комбінований.
Форми роботи: фронтальна бесіда,розповідь учителя, індивідуальна
робота,робота в парах,групова гра.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва,
презентація.
І. Організація класу
II. Актуалізація опорних знань. Повторення основних фактів і понять.
Повторимо такі питання:
1. Яку природу має електрон? Дуалізм атому.
2. Як електрони заповнюють простір навколо ядра?
1питання.Маса електрону 9,1093826(16)×10−31 кг і несе заряд.
Тому електрон можна вважати….?- частинкою.
Кожен електрон рухається навколо ядра так швидко,що неможливо навіть представити його у вигляді крапки.
Тому електрон можна вважати…..?- хвилею.
Дуалізм електрона полягає в подвійності його природи – частинки і хвилі.
2 питання. В атомі електрон перебуває не в одній конкретній точці, а рухаючись, утворює електронну хмару, електронна густина якої показує, в яких місцях електрон буває частіше, а в яких — рідше?
Ту частину електронної хмари, в якій електрон проводить 90% часу й у якій електронна щільність досить велика, називають орбіталлю.
Крім руху навколо ядра, електрон має ще і власний обертовий рух навколо своєї осі – спін.
Навколо ядра електрони можуть утворювати орбіталі (хмари) різної форми.
Орбіталі різної форми позначають різними літерами: s, p, d, f. Кулеподібна електронна хмара має назву s-орбіталь
Гантелеподібна електронна хмара має назву d- орбіталь.
Складної форми електронна хмара має назву d- орбіталь.
Ще більш складної форми електронна хмара має назву f –орбіталь.
Гра “Задай питання сусіду”:група з учнів(5-6) встає у шеренгу і задають по черзі питання. Учень, який відповів встає першим,якщо не відповів,або не може надати питання - переходить в кінець. Виграє учень ,який опинився першим. Учитель коментує вміння учнів надавати питання і навченість учнів. Виставляє бали.
III. Мотивація навчальної діяльності. Оголошення теми і мети уроку.
Під час хімічних реакцій ядро атома не змінюється, а змін зазнають оболонки атома, які називають електронними оболонками. Знаючи будову електронних оболонок можна пояснити властивості хімічних елементів. Тому під час вивчення хімії велика увага приділяється вивченню будови електронних оболонок атомів.
Сьогодні ми повторимо і поглибимо ваші знання про будову електронних оболонок атомів елементів,навчимось складати електронні та електронно-графічні формули елементів.
IV. Сприймання інформації.
Розглянемо такі питання:
1. Що таке енергетичні рівні, підрівні,радіус атому?
2. Який алгоритм складання електронної конфігурації атому певного
хімічного елементу?
1 питання. Орбіталі характеризуються не тільки формою, але й енергією.
Кілька орбіталей, що мають однакову або приблизно однакову енергію, утворюють енергетичний рівень (електронний шар).
Атомний радіус є величиною, яка показує розмір електронної оболонки атома.
У головних підгрупах із збільшенням заряду ядра атому радіус збільшується, тому що збільшується кількість електронних шарів. Приклад: серед елементів I групи головної підгрупи Li Na K Rb Cs Fr найбільший у атомів хімічного елементу Fr.
У періодах із збільшенням заряду ядра атому радіус зменшується, тому що в
атомах збільшується кількість протонів,які притягують електрони. Приклад:серед елементів 2 періоду Li Be B C N O F Ne найменший радіус у атомів хімічного елементу Ne.
Кожен рівень поділяється на підрівні - s, p, d, f, на яких розташовуються атомні орбіталі – s, p, d, f.
На першому рівні може бути один підрівень: s.
На другому рівні два підрівня: s ,p.
На третьому - три підрівні : s, p , d.
На четвертому – чотири: s, p, d, f.
2 питання. Алгоритм складання електронної конфігурації атому
певного хімічного елементу.
Запам’ятай правила!
1.Позначати кожну орбіталь коміркою – квадратиком,електрони - стрілочками.
2. Кількість орбіталей певного виду чітко визначена такими числам:
s-орбіталь – 1, ![]()
p-орбіталей – 3, ![]()
d-орбіталей – 5, ![]()
f-орбіталей – 7, ![]()
3.Заповнення підрівнів виконується в послідовності: s, p, d, f.
4.Кількість електронів в атомі визначається за порядковим номером
хімічного елементу в таблиці Д.І.Менделєєва.
5.Кількість електронних шарів визначається за номером періоду в таблиці
Д.І.Менделєєва. 6.За принципом Паулі, на кожній орбіталі може знаходитись максимально
два електрони,з антипаралельними спінами(стрілочки вверх-вниз).
7. За правилом Хунда на р ,d, f – орбіталях спочатку позначається по одному
електрону, потім заповнюємо повністю.
8.На першому рівні знаходиться максимум 2 електрони : два s -
1s2
на другому - максимум 8 електронів: два s ,шість р -
2s22p6
на третьому - максимум 18 електронів: два s, шість р, десять d-
3s2 3p6 3d10
V. Формування вмінь і навичок.
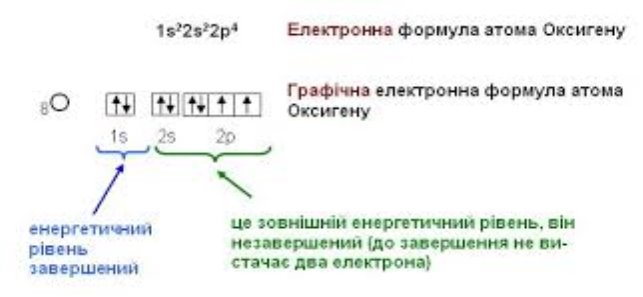
Запишемо електронну і графічну електронну формулу для атому Оксигену.
Розв'язання
1. Визначаємо число електронів у атомі Оксигену (порядковий номер
Оксигену - 8, отже в нього вісім електронів).
2. Визначаємо число енергетичних рівнів (знаходиться Оксиген у другому
періоді, отже він має два енергетичних рівні, які позначаються 1, 2.)
3. Записуємо можливі підрівні на енергетичних рівнях.
На першому енергетичному рівні є s-підрівень. Записуємо: 1s;
на другому енергетичному рівні є s- і p-підрівні. Записуємо: 2s 2p.
4. Розподіляємо 8 електронів по підрівнях, дотримуючись правил.
1s2 2s22p4
VI. Узагальнення та систематизація знань учнів.
Аналізуємо: другий рівень незавершений; Оксиген р-елемент;в атома два
неспарених електрони, тому валентність Оксигену II - завжди (немає вільних
орбіталей для збудженого стану).
 Самостійна робота в парах: записати електронну і графічну електронну формули для атому Неону (учитель надає допомогу учням).
Самостійна робота в парах: записати електронну і графічну електронну формули для атому Неону (учитель надає допомогу учням).
VII. Підбиття підсумків уроку. Оцінювання учнів.
VIII. Домашнє завдання:
Написати електронну і графічну електронну формули для атомів хімічних елементів з порядковими номерами 7,10 ,13.
Підручник 8 кл Григорович О.В. стор. 68-71 опрацювати, стор. 65-68 повторити .
\
Джерело інформації:
1. https://uk.wikipedia.org/wiki/Електронна_оболонка
2. http://techemy.com/uk/довідник/загальна-хімія/будова-атома/ядро-і-
електронна-оболонка-атома-будо/
3. http://shkolyar.in.ua/stan-elektroniv-u-atomi
4.http://elearning.sumdu.edu.ua/free_content/lectured:c63732c3bf9b7070c82625f128c
7980998d6c700/20151027105947/39633/index.html
5.Підручник хімія 8 клас Н.М.Буринська 2016р.
6.Підручник хімія 8 клас О.Г.ЯрошенкоУОВЦ “Оріон ” 2016р.
7.Підручник 8 клас О.В.Григорович “ Ранок ” 2016р.


про публікацію авторської розробки
Додати розробку
