Урок Ароматичні аміни. Анілін
Тема. Анілін: будова, властивості та застосування
Мета: з’ясувати склад, будову, властивості аніліну. Порівняти основні властивості метиламіну та аніліну. Розвивати знання про взаємний вплив атомів у молекулі. Виховувати уміння працювати в групі
Тип уроку: комбінований
Методи й методичні прийоми: словесні: розповідь, евристична бесіда, повідомлення учнів. Самостійна робота: хімічний диктант, робота з додатковою літературою. Продуктивні: проблемно-пошукові, робота в групах, прийом «Незакінчене речення»
Основні поняття й терміни: амоніак, бензен, анілін, анілін, взаємний вплив атомів у молекулі, основні властивості, вплив на організм людини.
Реактиви та унаочнення: портрет М.М.Зініна. Для кожного учня: завдання для хімічного диктанту, алгоритм для проведення рефлексії. Для кожної групи: література: Березан О.В.Органічна хімія / О.В.Березан. – Т. : Підручники і посібники, 2011. -272 с.; Базелюк І.І. Довідкові матеріали з хімії / І.І. Базелюк, Л.П. Величко, Н.В. Титаренко. – К. ; Ірпінь : Перун, 1998. – 224 с.; Егоров А.С. Химия внутр. Нас: Введение в бионеорганическую и биоорганическуюхимию / А.С. Егоров, Н.М. Иванченко, К.П. Шацкая. – Ростов-на-Дону : Феникс, 2004. – 192 с. Проектор, екран, комп’ютер .
Хід уроку
І. Організація класу.
ІІ. Перевірка домашнього завдання.№281, 290, 292
ІІІ. Актуалізація опорних знань. Хімічний диктант з теми «Аміни».
Інструкція. Уважно прочитайте текст. Вставте пропущені слова, словосполучення, формули.
І варіант
- Аміни – похідні…………………..в молекулах яких один чи декілька атомів Гідрогену заміщені на вуглеводневий радикал.
-
Речовина, формула якої
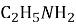 має назву…………………………………………
має назву…………………………………………
-
Горіння метиламіну виражається реакцією: 4С
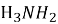 + 9
+ 9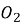 → 4…….. + 10……….. + 2……….
→ 4…….. + 10……….. + 2……….
- Краще виражені основні властивості у порівнянні з первинним аміном має…………………………амін.
- За агрегатним станом метиламін…………………………………
- Білий дим утворюється при взаємодії метиламіну з ………………………………………………………………………..
ІІ варіант
- За кількістю вуглеводневих залишків, сполучених з атомом Нітрогену, аміни поділяються на………….., ………………. та……………… .
-
Назва речовини, формула якої
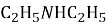 …………………………………………………………
…………………………………………………………
- Аміни проявляють властивості………………………………………………………
- Йон амонію утворюється за ………………………………………………………………………механізмом.
-
Горіння етиламіну виражається реакцією: 4…………….+15…………..→ ……С
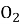 + …….
+ …….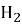 О +2……..
О +2……..
- Етиламін можна отримати з нітросполуки…………………………………………
IV. Мотивація навчальної діяльності. Повідомлення учня про історію відкриття аніліну.
На початку XIX ст., під час війни Франція перебувала в блокаді і була позбавлена необхідних товарів, які надходили із-за кордону. Не завозилась більше в країну і синя фарба індиго , яка була вкрай необхідна для фарбування мундирів солдат. Наполеон пообіцяв мільйон франків тому, хто відкриє спосіб одержання цього барвника із вітчизняної сировини. Але винагороду так ніхто і не отримав. Лише через 40
років, у 1842році, професор Казанського університету Микола Миколайович Зінін зробив відкриття, завдяки якому став можливим промисловий спосіб отримання не лише індиго. А й багатьох інших барвників. І вже у 1862 році на міжнародній виставці, яка проходила в Лондоні, з’явились перші зразки синтетичних барвників і пофарбовані ними тканини, хутро. Відвідувачів дивувала різноманітність та яскравість кольорів. Та найдивнішим було те, що всі ці барвники були отримані з однієї речовини аніліну, який отримували із кам’яновугільної смоли.
Саме цю дивну речовину ми вивчатимемо на цьому уроці.
V. Вивчення нового матеріалу. Які, на вашу думку, завдання нашого уроку?( що будемо вивчати? навіщо? З чим в асоціюється дана тема?) Чого ви очікуєте від уроку?
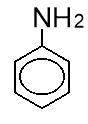
Анілін - найпростіший ароматичний амін, у молекулі якого, подібно до фенолу, проявляється взаємний вплив атомів. З одного боку, бензенове кільце притягує до себе електронну густину від атома Нітрогену аміногрупи. Зменшення електронної густини на атомі Нітрогену приводить до зниження здатності відщеплювати протон від слабких кислот. Тому анілін – слабша основа, ніж метиламін ї, етиламін чи амоніак. Наприклад, амоніак забарвлює лакмус у синій колір, анілін – ні.
C6H5-NH2 <NH3 < R3N<R-NH2 <R2NH
-------------------------------------------------→
Посилюються основні властивості
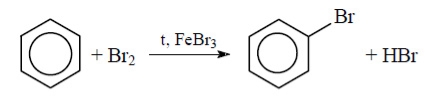
З іншого боку, під впливом аміногрупи бензенове кільце стає активнішим в реакціях заміщення у порівнянні з бензеном. Зокрема, бензен реагує з бромом лише у присутності каталізатора – ферум броміду –і заміщується лише один атом Гідрогену, утворюється бромобензен:
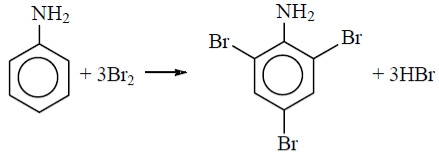
Анілін реагує з бромом без каталізатора, при цьому відбувається заміщення одночасно трьох атомів Гідрогену і утворюється 2,4,6-триброманілін (білий осад).
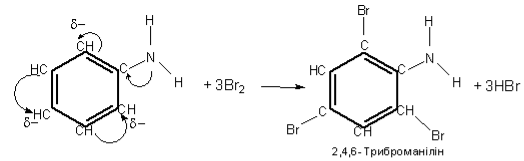
Ця реакція може бути використана для якісного і кількісного визначення аніліну.
Хімічні властивості
- Реакції за участю аміногрупи. На відміну від метиламіну анілін взаємодіє лише з сильними кислотами:
C6H5-NH2 + HCl → [C6H5-NH3]+Cl-
Феніламоній хлорид
[C6H5-NH3]+Cl- + NaOH → C6H5-NH2 + NaCl + ![]()
[C6H5-NH3]+ + Cl-+ ![]() +
+ ![]() → C6H5-NH2 +
→ C6H5-NH2 + ![]() +
+ ![]() +
+ ![]()
[C6H5-NH3]++ ![]() → C6H5-NH2 +
→ C6H5-NH2 + ![]()
- Реакції за участю бензенового ядра
-
Реакції окиснення. Анілін, на відміну від бензену, окислюється на повітрі, перетворюючись на різні сполуки. Це результат впливу аміногрупи на бензинове ядро. При окисненні аніліну сумішшю калій дихромату
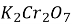 і концентрованої сульфатної кислоти утворюється барвник чорного кольору – так званий чорний анілін. При додаванні хлорного вапна або хлорної води до розчину аніліну утворюється фіалкове забарвлення. У такий спосіб можна визначити навіть незначну кількість аніліну.
і концентрованої сульфатної кислоти утворюється барвник чорного кольору – так званий чорний анілін. При додаванні хлорного вапна або хлорної води до розчину аніліну утворюється фіалкове забарвлення. У такий спосіб можна визначити навіть незначну кількість аніліну.
Добування
Основний спосіб добування аніліну – відновлення нітробензену воднем за температури 250—350оС та наявності каталізатора.
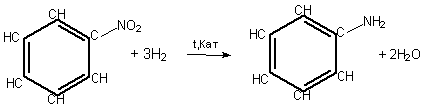
Відновлення нітробензену до аніліну відоме в історії хімії як реакція М.М.Зініна (1842 р.). Як відновник використовував амоній сульфід ( ![]() )2S
)2S
Застосування (презентація, підготовлена учнем) у виробництві:
- Барвників ( 50% видів синтетичних барвників);
- Фуксину – темно-фіолетовий, переходить у зелений;
- Анілінового чорного;
- Індиго ;
- Лікарських препаратів;
- Гербіцидів;
- Пластмас .
Цікаво. З’ясуйте молекулярну формулу речовини, якщо якісний аналіз показав, що до її складу входить 80% Карбону; 8,3% Гідрогену; 11,7% Нітрогену. Молекулярна маса цієї речовини 120. ( фенілетиламін – ФЕЛ; ![]() ).
).
Дослідження показали, що в період закоханості залози внутрішньої секреції виробляють речовину ФЕА. Чим більше її виділяється, тим пристрасніше кохання.
Група –проект: 1 група. Використовуючи літературу, яка є на ваших партах, підготуйте за 5 хв повідомлення про ознаки отруєння аніліном.
2 група. Використовуючи літературу, яка є на ваших партах, підготуйте за 5 хв повідомлення про першу допомогу при отруєнні аніліном.
Тези 1-ї групи. Анілін, потрапляючи у кров утворює з гемоглобіном досить стійку сполуку метгемоглобін. Через це кров нездатна транспортувати кисень до тканин організм у і настає гостре кисневе голодування. Смертельна доза аніліну 10-20г. У разі легкого отруєння аніліном спостерігається слабкість, запаморочення, головний біль, синюшність губ, вушних раковин і нігтів. У випадку отруєння середньої тяжкості також спостерігається нудота, блювота, іноді хитання під час ходьби.
Тези 2-ї групи. Перша допомога: вивести потерпілого з осередка отруєння, облити теплою (але не гарячою) водою. Також потрібне вдихання кисню з карбогеном ( 70% О2 і 30% С![]() ). Крім цього застосовують кровопускання, введення серцево-судинних засобів. Слід надати потерпілому спокій.
). Крім цього застосовують кровопускання, введення серцево-судинних засобів. Слід надати потерпілому спокій.
VІ. Узагальнення та систематизація знань.
- У чому подібність аніліну та бензину?
- У чому подібність аніліну та амоніаку?
- Які галузі застосування аніліну вам відомі?
- Розташуйте в ряд за збільшенням основності такі речовини: анілін, метиламін, диметиламін, амоніак, дифеніламін. Відповідь обґрунтуйте.
-
Вкажіть реакції, характерні для аніліну: а) C6H5-NH2+
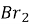 →…..; б) C6H5-NH2+ NaOH →……..;
→…..; б) C6H5-NH2+ NaOH →……..;
в) C6H5-NH2+НСl→…….; г) C6H5-NH2+![]() →……
→……
6. Обчисліть масу феніл амоній хлориду, якщо до аніліну масою 13,95г додали хлороводень, що виділився на першій стадії хлорування метану об’ємом 5л(н.у.)
7. Обчисліть масу аніліну, яку можна одержати в результаті відновлення нітробензену масою 246г, якщо масова частка виходу продукту реакції від теоретично можливого становить 0,9.
VІІ. Підсумок уроку. Рефлексія.. Чи справдились ваші очікування? (Метод «Незакінчене речення» – використовуючи алгоритм продовжити речення):
- Сьогодні я дізнався…
- Я зрозумів, що …
- Тепер я хочу.. .
- Я відчув, що
- Я набув ……
- Мені вдалося …
- Я зміг ……..
- Я спробував… .
- Мене здивувало …
- Було цікаво…
- Було складно…
- Я виконував завдання….
- Урок мені дав для життя …
- Мені захотілося ……..
VІІ. Домашнє завдання. Вивчити § 27; письмово: №204 (Попель П.П.). Підготувати повідомлення про незамінні амінокислоти. Розпочати роботу над груповим проектом: І група «Функції білків»; ІІ група «Цінність білків для організму людини»; ІІІ група «Денатурація білка в результаті радіоактивного опромінення»
1


про публікацію авторської розробки
Додати розробку