Урок "Будова молекули води, поняття про водневий зв’язок"
ТЕМА УРОКУ: Будова молекули води, поняття про водневий зв’язок.
МЕТА УРОКУ: узагальнити знання про роль води в природі та діяльності людини; ознайомити з властивостями води як універсального розчинника; продовжувати формування уявлення про залежність речовин від їх будови; розвивати знання про хімічний зв'язок і будову речовини на прикладі будови молекули води; ознайомити з особливістю будови молекули води, здатністю утворювати водневі зв’язки.
ХІД УРОКУ
І. Організація класу.
Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів.
ІІ. Мотивація уроку.
ІІІ. Повідомлення теми, мети уроку.
IV. Актуалізація знань.
Бесіда
- Які системи називаються розчинами?
- Чим відрізняються істинні розчини від дисперсних систем?
- Наведіть приклади різних дисперсних систем, у тому числі й розчинів, які можна віднести до того чи іншого класифікаційного типу
V. Вивчення нового матеріалу.
Епіграф уроку:
 «Вода! Ти не маєш ні смаку, ні запаху, тебе не опишеш, тобою насолоджуєшся, не розуміючи, що ти є. Ти не просто необхідна для життя, ти і є життя»
«Вода! Ти не маєш ні смаку, ні запаху, тебе не опишеш, тобою насолоджуєшся, не розуміючи, що ти є. Ти не просто необхідна для життя, ти і є життя»
Антуан де Сент-Екзюпері
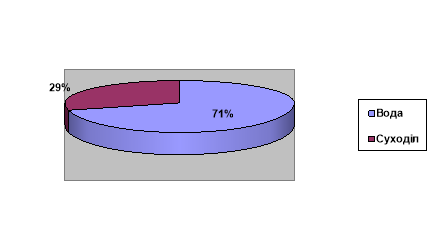
Вода: 96,5 % - морська вода, 3,5% - прісна вода (Льодовики – 69%, Підземні води - 30%, Річки, озера, болота, штучні водойми, багаторічна мерзлота, атмосферна волога – 1%)
- РОЛЬ ВОДИ В ПРИРОДІ ТА ДІЯЛЬНОСТІ ЛЮДИНИ (Відеофайл)
- Вода - єдина речовина, яка зустрічається на Землі в усіх трьох агрегатних станах
- Вода в організмі людини
- Вода в овочах і фруктах
- Вода в житті людини
- Вода – універсальний розчинник, вічний двигун живої і неживої природи
2. БУДОВА МОЛЕКУЛИ ВОДИ
Бесіда
- Які типи хімічного зв’язку ви знаєте?
- Визначте тип хімічного зв’язку і напишіть електронну формулу молекули води.
- Якою є геометрична будова молекули?
Молекулярна формула води
Графічна формула води
Кулестержнева модель води
Масштабна модель води
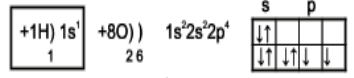
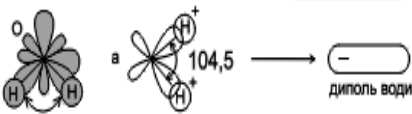
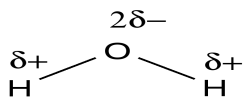

З погляду геометрії в будові молекули води важко знайти щось надзвичайне: атом Оксисену, до якого приєднані два атоми Гідрогену. Усі атом, які утворюють молекулу, лежать в одній площині.
3. ВОДНЕВИЙ ЗВЯЗОК
Від’ємний заряд молекули води (Оксисен) і позитивний заряд (Гідроген)перебувають на різних кінцях молекули. Тому в цілому електронейтральна молекула води має позитивний та негативний полюси. Молекули, у яких розділені позитивні та негативні заряди, називаються дипольними, або диполями. Наявність значного дипольного моменту у води призводить до того, що її молекули-магнітики – сильно притягуються одна до одної. Унаслідок взаємодії диполів води міжатомні та міжмолекулярні сили на поверхні занурення в неї речовини стають у 80 разів слабшими. Інакше кажучи, вода має найвищу з усіх відомих нам сполук діелектричну проникність.
Тепер поговоримо про особливості атома Гідрогену, оскільки 2/3 молекули води складаються з атомів Гідрогену.
Гідроген від інших елементів періодичної системи Д.І.Менделєєва відрізняє одна особливість. Усі хімічні елементи, які в реакціях віддають електрони, залишаються після цього з деякою кількістю електронів. Усі, але не Гідроген, який і має всього лише один електрон. Віддавши його, Гідроген залишається зовсім без електронної оболонки. Інакшими словами, те, що ми називаємо йоном Гідрогену, є голим ядром, елементарною часткою – протоном.
Розміри атомного ядра в багато разів – приблизно в 100 тисяч – менші за розміри атома. Тому йон гідрогену, порівняно з іншими однозарядними позитивними йонами, має невідчутні розміри. Згідно з фізичними законом, тіла, що мають однакові заряди, утворюють поле, напруженість якого обернено пропорційна квадрату його радіуса. Тому напруженість поля, яке утворює протон, у багато разів перевищує напруженість поля, яке утворюють інші позитивні йони. Два протони Гідрогену, які вступили у взаємозв’язок з йоном Оксисену, повинні були нейтралізувати заряди. Але поле, яке утворюється протоном у сполуці H2O, не насичується негативними зарядами Оксисену. Йони Гідрогену ще зберігають здатність вступати у взаємодію. Цей додатковий зв’язок так і називається водневий.
VI. Закріплення знань учнів.
Запитання:
- Яке значення розчинів в житті людини?
- Яка роль води як універсального розчинника в природі?
- Який тип зв’язку спостерігається в молекулі води? Яка її будова з точки зору електронної будови атома?
- Що таке диполь і в результаті чого молекула води є диполем?
- Що таке водневий зв’язок?
VIІ. Завдання додому.
- Вивчити § підручника.
- Виконати завдання після параграфа.
- Підготувати цікаві повідомлення про властивості води.
VIIІ. Підсумок уроку.
Підсумовується робота учнів на уроці, визначаються змістовні і слабкі відповіді, виставляються оцінки за урок.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ:
Література:
- Попель П.П. Хімія: підруч. для 9 кл. загальноосвіт. навч. закл. / П.П.Попель, Л.С.Крикля – К.: ВЦ «Академія», 2009 – 232 с.: іл. (книга двох авторів).
- Дігавцова Л.Ю. Хімія. 9 клас : Плани-конспекти уроків на друкованій основі / Л. Ю. Дігавцова — Х. : Вид-во «Ранок», 2013. — 128 с. — (Серія «Конструктор уроку»). (книга одного автора).
- Старовойтова І.Ю. Усі уроки хімії 9 клас / І.Ю.Старовойтова, О.В.Люсай. – Х.: Вид. Група «Основа», 2009 – 239, [1]с.: іл.,табл. – (Серія « 12 – річна школа»). (книга одного автора).
- Григорович О.В. Хімія. 9 клас: Плани-конспекти уроків / О.В.Григорович, А.В.Віценцик, О.М. Гостинникова. – Х.: Вид-во «Ранок», 2009. – 304 с. + Додаток (16с.). – (Серія «Майстер клас») (книга трьох авторів). [Електронний ресурс]. – Режим доступу: https://www.slideshare.net/olenameskova/ss-59950953 (електронне джерело).
- [Електронний ресурс]. – Режим доступу: http://edufuture.biz/index.php?title=Вода_як_розчинник._Будова_молекули_води,_поняття_про_водневий_зв’язок (електронне джерело).
- [Електронний ресурс]. – Режим доступу: http://www.chemistry.in.ua/grade-9/solutions-and-dispersed-systems#more-1124 (електронне джерело).
- [Електронний ресурс]. – Режим доступу: http://mypresentation.ru/presentation/130120_mou_sosh_5_stbrinkovskaya_urok_po_teme_chistaya_voda_podgotovila_uchitel_ximii_beba_ea (електронне джерело).
- [Електронний ресурс]. – Режим доступу: http://pt.slideshare.net/ssuser35f5f51/5187-7 (електронне джерело).
- [Електронний ресурс]. – Режим доступу: http://kuchka.info/znachennya-rozchyniv-u-pryrodi-ta-zhytti-lyudyny-rozchyny-i-joho-komponenty-rozchynnyk-rozchynena-rechovyna-voda-yak-polyarnyj-rozchynnyk.html(електронне джерело).
1

про публікацію авторської розробки
Додати розробку
