Урок "Електроліти, неелектроліти"
Тема 1: Електролітична дисоціація. Електроліти й неелектроліти.
Мета уроку :
- формувати уявлення учнів про процеси, що відбуваються в розчинах;
- ознайомити з поняттям «електролітична дисоціація»;
- пояснити залежність електролітичної дисоціації від будови молекул розчиненої речовини й розчинника;
- ознайомити учнів з поділом речовин на електроліти й неелектроліти за електропровідністю в розчині або розплаві.
Тип уроку: засвоєння нових знань.
Форми роботи: розповідь, демонстраційний експеримент, інтерактивна дошка.
Обладнання: таблиця розчинності, медіа фільм, демонстрація.
Хід уроку.
І. Організаційний етап.
ІІ. Оголошення теми й мети уроку. Мотивація навчальної діяльності.
- Ми знаємо з вами, що метали проводять електричний струм.
- Чому ця властивість притаманна металам?
- Який метал має найвищу електропровідність?
- Назвіть речовини, що проводять електричний струм?
Проведемо експеримент: занурюємо електроди в дистильовану воду й подаємо струм у систему. Лампочка не горить. І навпаки – в звичайну воду. Лампочка загорається. 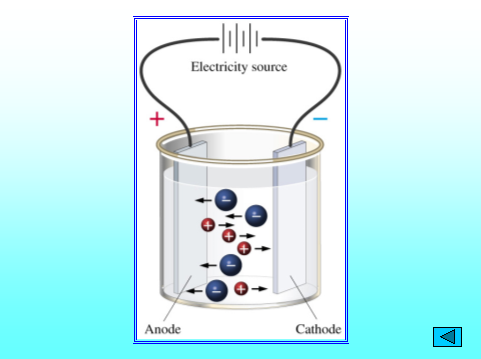
Техніка безпеки: нагадаємо, що прилади не можна гасити водою, торкатися електричних дротів, електричних приладів мокрими руками.
Проблемне питання: Чим відрізняються дані води між собою?
Експеримент: сухі електроди зануримо в сухий натрій хлорид – лампочка не горить. Тепер у розчин натрій хлориду – лампочка горить. 
Висновок : розчинені у воді кристали зробили розчин електропровідним.
Проведемо аналогічні дослдіження з цукром. Розчин не проводить електричний струм.
Отже, речовини, розчини й розплави, яких проводять електричний струм, називаються електролітами. ( солі, кислоти, основи, тобто, речовини з йонним та ковалентним полярним типом зв’язку).
Речовини, що не проводять електричний струм, називають неелектролітами. ( Це прості речовини_ неметали. Речовини не молекулярної будови, більшість органічних кислот).
ІІІ. Вивчення нового матеріалу.
Електролітична дисоціація.
Переглядаємо медіафільм – схему дисоціації. 
Основні положення ТЕД.
- Дисоціація електролітів відбувається під дією полярних молекул розчинника.
- Дисоціація – оборотний процес, зворотній процес- асоціація.
- Молекули , що дисоціюють, розпадаються на катіони та аніони.
Розглянемо приклади
Na2SO4↔↔ 2 Na+ + SO2-4
ІV. Узагальнення знань

Самостійно запишіть рівняння дисоціації:
КОН→
СаСІ2→
НNО3→
ІV. Підсумок уроку.
Які явища супроводжують розчинення?
Чи завжди в розчині протікатимуть усі перелічені процеси?


про публікацію авторської розробки
Додати розробку
