Урок "Фізичні властивості оксидів. Поширеність у природі та використання оксидів. Вплив на довкілля і здоров’я людини".
Тема: Фізичні властивості оксидів.Поширеність у природі та використання оксидів. Вплив на довкілля і здоров’я людини.
Мета:
навчальна: ознайомити учнів з фізичними властивостями оксидів, їх поширенням в природі; розвивати вміння класифікувати складні неорганічні речовини, оксиди; за назвою речовини складати її формулу;
розвивальна: активізувати пізнавальну активність учнів, сприяти розвитку логічного мислення, формувати вміння використовувати придбані знання на практиці;
виховна: творче ставлення до справи, старанність, працьовитість, відповідальність за результати своєї роботи; комунікабельність, вміння працювати самостійно і в колективі.
Тип уроку: комбінований
Обладнання: зразки оксидів, періодична система хімічних елементів Д. І. Менделєєва, комп’ютер, таблиця розчинності кислот, основ і солей у воді
Очікувані результати: учні дають назви оксидам, розрізняють несолетворні й солетворні (кислотні, основні, амфотерні) оксиди, встановлюють зв’язок між типами кристалічних граток оксидів та їх властивостями, описують поширення оксидів в природі.
ХІД УРОКУ:
1. Організаційна частина (привітання, перевірка наявності учнів; організація уваги учнів до уроку).
2. Актуалізація опорних знань учнів
2.1 Фронтальне опитування:
1) Що таке складні речовини?
2) На які класи поділяються складні речовини?
3) Як називаються складні речовини які складаються з двох елементів, один з яких Оксиген?
4) Які речовини називаються кислотами?
5) Як називаються складні речовини які складаються з атомів металів та кислотних залишків?
6) Які речовини називаються основами?
2.2 Заповнення таблиці (робота в зошиті)
Розподілити запропоновані речовини на кислоти, основи, оксиди, солі.
BaO, Al2O3, H3PO4, MgCl2, KOH, HNO3, CO2, Cr2(SO4)3, N2O, Ca(OH)2
|
Основи |
Оксиди |
Кислоти |
Солі |
|
|
|
|
|
2.3 Індивідуальні завдання (робота в зошиті)
1 варіант – дати класифікацію оксидам;
2 варіант – дати назви оксидам;
3 варіант – обчислити відносні молекулярні маси оксидів.
Перевірка та аналіз виконаних завдань.
3. Постановка завдання уроку
Бінарні звуться ці Сполуки.
В них, міцно взявшись за руки,
Два елементи сполучились.
Які сполуки утворились? (Оксиди)
- Які ви знаєте оксиди?
- Де вони поширені?
- Чому вони мають різний агрегатний стан?
Сьогодні на уроці ми розглянемо основні фізичні властивості оксидів та їх поширення в природі.
4. Пояснення нової теми
4.1 Бесіда
- Які типи хімічного зв’язку в неорганічних речовинах вам відомі?
- Які типи кристалічних граток вам відомі?
- Яким чином властивості речовин залежать від типу кристалічної гратки?
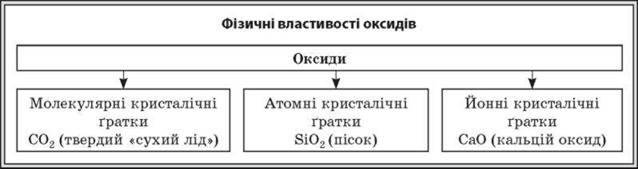
Розповідь вчителя: За стандартних умов більшість оксидів — тверді речовини (BaO, CuO, Р2О5), деякі — рідкі (Сl2О7, Н2О) і газуваті (СО2, NО). Це залежить від будови їхньої кристалічної гратки. Більшість оксидів металічних елементів складається з йонів і є твердими речовинами. Вони як правило не розчиняються у воді, мають високі температури плавлення.
Мають різний колір.
- магній оксид МgО (білого кольору)
- ферум(ІІІ) оксид Fe2O3 (бурого кольору)
- нітроген(ІV) оксид NO2 (бурого кольору)
- хлop(IV) оксид СlO2 (зеленкувато-жовтого кольору)
- силіцій(ІV) оксид SiO2 (безбарвний).
Деякі оксиди мають запах: SO2 – різкий, задушливий; NO2 – задушливий.
4.2 Демонстрація оксидів: CaO, H2O, SiO2, CuO. Вказати їх агрегатний стан, колір.
4.3 Поширення оксидів в природі
П'ятеро учнів заздалегідь підготували повідомлення про особливості та поширення оксидів: пісок, вода, вуглекислий газ, негашене вапно, чадний газ
5. Закріплення теми уроку
5.1 Заповнення таблиці (або складання діаграми Вена). Порівняльна характеристика вуглекислого та чадного газів.
|
Ознаки |
Чадний газ |
Вуглекислий газ |
|
Формула |
|
|
|
Хімічна назва |
|
|
|
Тип хімічного зв'язку |
|
|
|
Тип кристалічної гратки |
|
|
|
Агрегатний стан |
|
|
|
Важчий чи легший за повітря |
|
|
|
Поширення в природі |
|
|
|
Вплив на організм людини |
|
|
5.2 Робота з підручником. Розглянути галузі застосування оксидів.
5.3 Розв’язати задачу. Обчисліть кількість речовини, що міститься в кальцій оксиді масою 112 г.
6. Підбиття підсумків уроку
Учні разом з учителем перевіряють правильність виконаних завдань, виправляють помилки. Учитель підбиває підсумки уроку, оцінює, заохочує найбільш активних учнів.
7. Пояснення домашнього завдання
1. Опрацювати матеріал підручника с 125, 141-142 (підручник П.П Попель, Л.С.Крикля)
2. Виконати вправу 207, с.146

про публікацію авторської розробки
Додати розробку
