Урок хімії 9 клас із застосуванням ИКТ по темі "Метан представник насичених вуглеводнів."
Розробка уроку по темі "Метан як представник насичених вуглеводнів." на уроці використовуються ІК технології а саме презентація та робота з програмою Avogadro або PowerPoint. Урок зацікавить учнів та допоможе вчителям.
Урок хімії 9 клас із застосуванням ИКТ по темі "Метан представник насичених вуглеводнів."
Мета уроку:.
Навчальна: на прикладі метану познайомити учнів з алканами, розглянути гомологічний ряд насичених вуглеводнів, будова, фізичні й хімічні властивості, способи їхнього одержання, застосування.
Розвиваюча: розвити поняття про просторову будову насичених вуглеводнів; розвиток пізнавальних інтересів, творчих і інтелектуальних здібностей, розвиток самостійності в придбанні нових знань із використанням нових технологій.
Виховна: показати єдність матеріального світу на прикладі генетичного зв'язку вуглеводнів різних гомологічних рядів.
Устаткування: комп'ютер, мультимедіа проектор, екран, презентація.
Очікувані результати:
Учні знають, які вуглеводні називають насиченими; уміють становити молекулярні й структурні формули граничних вуглеводнів, виходячи із загальної формули алканів; характеризувати фізичні й хімічні властивості метану, його застосування.
Хід уроку
І. Організаційний момент.
Здрастуйте! Я радий вас усіх бачити. Сьогодні на уроці ми будемо говорити про перший клас органічних речовин. Я впевнений, що наша продуктивна робота допоможе нам досягти мети сьогоднішнього уроку.
ІІ. Мотивація навчальної діяльності.
Тему нашого уроку ви зможете сформулювати, прослухавши уривок з вірша .
Уголь лихо били пики,
Рокотали молотки,
И мерцали на них лики,
Как на солнце лепестки.
И работа текла гладко,
Но не спал в пласте метан,
И готовился украдкой
Брызнуть в лаву, как фонтан.
Оставался час до смены,
И потом шабаш – домой,
Но метан внёс перемены,
Вспышкой грозной огневой.
IIІ. Оголошення теми уроку.
Вчитель
Тема уроку: " Насичені вуглеводні". Слайд № 1
План вивчення алканів. Слайд № 2
- Визначення. Загальна формула класу вуглеводнів.
- Гомологічний ряд.
- Будова насичених вуглеводнів.
- Фізичні властивості.
- Хімічні властивості.
- Поширення в природі.
- Застосування.
ІV. Актуалізація знань.
Фронтальне опитування: Що вивчає органічна хімія? Які речовини називають органічними? Які сполуки називають вуглеводнями?
Складання кластера біля дошки «Класифікація вуглеводнів».
![]()
![]()
![]()
![]()
V. Вивчення нового матеріалу.
Насичені вуглеводні. На прикладі метану.
Алкани - вуглеводні в молекулах яких всі атоми вуглецю зв'язані одинарними зв'язками й мають загальну формулу: Cn2n+2 Слайд № 3
- Що таке гомологи?
Гомологи - це речовини, подібні по будові й властивостям і відрізняються на одну або більше груп СH2.
Гомологічний ряд метану
СН4 метан
З2H6 этан
C3H8 пропан
C4H10 бутан
C5H12 пентан
C6H14 гексан
C7H16 гептан
C8H18 октан
C9H20 нонан
C10H22 декан Слайд № 4
Будова алканів. Слайд №5
Кожен атом Карбону в алканах перебуває в стані sp3-гібридизації й утворює чотири σ-зв’язки С-С або С-Н , кути між якими дорівнюють 109,5°. Завдяки такій орієнтації зв’язки від одного атома Карбону в алканах спрямовані до вершин тетраедра. Довжина зв’язку С-С в алканах дорівнює 0,154 нм, енергія зв’язку — 354 кДж/моль.
Атом Карбону утворює σ-зв’язок за рахунок перекривання гібридних орбіталей (sр3-, sр2- або sр-атомних орбіталей) з гібридними орбіталями іншого атома Карбону або будь-якими орбіталями атомів інших елементів. Перекривання здійснюється таким чином, що область максимальної електронної густини зосереджується в просторі між ядрами на прямій, що з’єднує центри атомів. Таке перекривання виявляється найбільш ефективним, а а -зв’язки, які при цьому виникають, — найбільш міцними.
Фізичні властивості. Слайд № 6
|
|
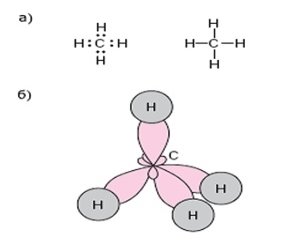
CH4 – молекулярна формула метану
Графічна й електронна формули метану. (а)
Перекриття електронних орбіталей в молекулі метану. (б)
Мета́н безбарвний газ без запаху, малорозчинний у воді, легше повітря. При використанні в побуті, промисловості в метан звичайно додають одоранти зі специфічним «запахом газу». Накопичуючись у закритому приміщенні, метан стає вибухонебезпечний. Збагачення одорантами робиться для того, щоб людина вчасно помітила витік газу. Вибухонебезпечний при концентрації в повітрі від 4,4 % до 17 % Слайд № 7
СН4:C4Н10 - гази
T кипіння: -161,6:-0,5 °C
T плавлення: -182,5:-138,3 °C
З5Н12:C15Н32 - рідини
T кипіння: 36,1:270,5 °C
T плавлення: -129,8:10 °C
З16Н34:і далі- тверді речовини
T кипіння: 287,5 °C
T плавлення: 20 °C
Зі збільшенням відносних молекулярних мас граничних вуглеводнів закономірно підвищуються їхні температури кипіння й плавлення.
(Фізкультхвилинка)
Поширення в природі. Слайд № 8
Основний компонент природного газу (77—99 %), супутніх нафтових газів (31—90 %), рудничного і болотного газів (звідси відбулися інші назви метану — болотний або рудничний газ). В анаеробних умовах (у болотах, перезволожених ґрунтах, кишківнику травоїдних тварин) утворюється біогенно у результаті життєдіяльності деяких мікроорганізмів.
Більші запаси метану зосереджені в метаногідратах на дні морів у зоні вічної мерзлоти.
За сучасним даними, в атмосферах планет-гігантів сонячної системи в помітних концентраціях утримується метан.
Приблизно, на поверхні Титана в умовах низьких температур (−180 °C) існують цілі озера й ріки з рідкої метано-этанової суміші.
Хімічні властивості Слайд №9
Для метану характерні наступні типи хімічних реакцій:
1) Горіння метану:
CH4 + 2O2 > CO2 + 2H2O + Q
2) Реакція галогенування: Слайд №10
CH4 +Cl2 -> CH3Cl + HCl
Застосування. Слайд №10
(Можливо, заздалегідь підготовлені виступи учнів.)
Широко використовуються як паливо, у тому числі для
двигунів внутрішнього згоряння, а також при виробництві сажі
(1 - картриджі; 2 - гума; 3 - типографічна фарба), при одержання органічних речовин (4 - розчинників; 5 - хладогенів, використовуваних у холодильних установках; 6 - метанол; 7 - ацетилен) Слайд № 11
VI. Закріплення. Слайд №12
- Назвіть 2 найближчих гомолога для пентану й назвіть їх.
- Визначити граничний вуглеводень, щільність пар якого по повітрю дорівнює 2. (C4H10).
- Створити 3D модель представника гомологічного ряду за допомогою програми Avogadro
VII. Домашнє завдання: Слайд №13
§ 25 Прочитати. Відповісти на питання.
Вправа 287
-
-
Дякую!


про публікацію авторської розробки
Додати розробку