Урок "Хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами, основами, солями. Ряд активності металів. "
Мета: навчальна - ознайомити учнів з хімічними властивостями кислот, розширити знання учнів про типи хімічних реакцій, сформувати вміння застосовувати ряд активності металів для прогнозування можливості перебігу хімічних реакцій, повторити та закріпити вміння та навички хімічного експерименту;
розвиваюча - продовжити розвивати вміння працювати у групах, рнавички складання хімічних рівнянь реакцій, розвивати вміння спостерігати за проведеними лабораторними дослідами та робити висновки;
виховна - виховувати акуратність, організованість під час роботи з хімічними речовинами та лабораторним посудом, продовжити виховувати культуру спілкування.
Тип уроку: комбінований урок.
Наскрізні змістові лінії:
Громадянська відповідальність: використання оксидів, кислот, основ і середніх солей. Вплив на довкілля.
Здоров'я і безпека: заходи безпеки під час роботи з кислотами і лугами.
Екологічна безпека і сталий розвиток: Безпечне поводження з речовинами. Поширеність у природі та використання оксидів, кислот, основ і середніх солей. Вплив на довкілля.
Тема: Хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами, основами, солями. Ряд активності металів
Мета: навчальна - ознайомити учнів з хімічними властивостями кислот, розширити знання учнів про типи хімічних реакцій, сформувати вміння застосовувати ряд активності металів для прогнозування можливості перебігу хімічних реакцій, повторити та закріпити вміння та навички хімічного експерименту;
розвиваюча - продовжити розвивати вміння працювати у групах, рнавички складання хімічних рівнянь реакцій, розвивати вміння спостерігати за проведеними лабораторними дослідами та робити висновки;
виховна - виховувати акуратність, організованість під час роботи з хімічними речовинами та лабораторним посудом, продовжити виховувати культуру спілкування.
Обладнання та реактиви: Періодична система хімічних елементів, таблиця розчинності, зміна забарвлення індикаторів у середовищах, ряд активності металів, хімічні реактиви: розчини хлоридної та сульфатної кислот, лакмус, метилоранж, фенолфталеїн, магній, мідь,цинк, пробірки.
Тип уроку: комбінований урок.
Громадянська відповідальність: використання оксидів, кислот, основ і середніх солей. Вплив на довкілля.
Здоров’я і безпека: заходи безпеки під час роботи з кислотами і лугами.
Екологічна безпека і сталий розвиток: Безпечне поводження з речовинами. Поширеність у природі та використання оксидів, кислот, основ і середніх солей. Вплив на довкілля.
Державні вимоги до рівня загальноосвітньої підготовки учнів:
Знаннєвий компонент
називає кислоти за сучасною науковою українською номенклатурою;
наводить приклади оксигеновмісних і безоксигенових, одно-, дво-, триосновних кислот;
Діяльнісний компонент
розрізняє кислоти за складом (оксигеновмісні, безоксигенові) та основністю (одно-, дво-, триосновні), середні солі; реакції заміщення;
складає формули кислот;
класифікує неорганічні сполуки за класами;
характеризує поняття кислот;
установлює генетичні зв’язки між простими і складними речовинами, основними класами неорганічних сполук;
використовує сучасну українську номенклатуру основних класів неорганічних сполук; таблицю розчинності кислот, основ та солей для складання рівнянь хімічних реакцій; індикатори для виявлення кислот;
прогнозує перебіг хімічних реакцій солей і кислот з металами, використовуючи ряд активності металів;
дотримується запобіжних заходів під час роботи з кислотами і лугами
Ціннісний компонент
обґрунтовує залежність між складом, властивостями та застосуванням неорганічних речовин;
оцінює значення найважливіших представників основних класів неорганічних сполук.
Без сумніву, всі наші знання починаються з досвіду…
І. Кант
Хід уроку
І. Організаційний етап
Створення робочої атмосфери, перевірка готовності до уроку
Вчитель:
Не просто слухати, а чути,
Не просто дивитися, а бачити,
Не просто відповідати, а міркувати,
Дружно і плідно працювати!
ІІ. Перевірка раніше засвоєного матеріалу
Хімічний диктант
1. Серед запропонованих формул запишіть окремо основні класи неорганічних сполук:
HCl, KOH, CaO, Zno, SO3, HI, NaOH, H2SO4, H2O, MnO, H3PO4, AlCl3, K2O, ZnSO4, HNO3, P2O5, Mg(OH)2, Na2CO3
2. Назвіть їх за сучасною хімічною номенклатурою
Фронтальне опитування
1. Що таке кислоти?
2. Із чого складаються кислоти?
3. На які групи вони поділяються?
4. Записати приклади кислот та дати їм назви.
5. Які речовини називаються кислотам?
6. Атом якого елемента входить до складу всіх кислот?
7. Яких правил техніки безпеки ми повинні дотримувати під час роботи з кислотами?
Індивідуальна робота ( для двох учнів)
1. Класифікуйте хлоридну кислоту за всіма ознаками.
2. Класифікуйте нітратну кислоту за всіма ознаками.
ІІІ. Мотивація навчально-пізнавальної діяльності і повідомлення теми, мети і завдань уроку
Казка про хлоридну кислоту
В одній хімічній лабораторії в Натрій Хлориду й концентрованої Сульфатної кислоти народився хлопчик на ім’я Гідроген Хлорид. Він був таким непомітним, безбарвним. Опуститься собі десь у куточок, і ніхто його не помічає. Тільки запах його виказував – такий різкий, що в усіх викликав ядуху. А ось характер у Гідроген Хлориду підступний, їдкий. Ніхто його особливо не любив за це. Лише тиха, безбарвна Вода полюбила Гідроген Хлорид настільки, що в одному об’ємі могла розчинити 500 об’ємів його.
І народилась від цього великого кохання дівчинка, дуже схожа зовні на маму Воду, але характером – на тата Гідроген Хлорид. І назвали її Хлоридна Кислота.
Здавалося б, така тиха й безбарвна, як мама Вода, Хлороводнева Кислота мала дуже сильний характер, була в’їдливою, як її тато. Вона аж диміла від злості.
Метали від неї тікали, як від чуми, вона їх перетворювала на солі. Тільки Мідь, Ртуть, Золото і Срібло не боялися Хлоридної Кислоти. Та коли вони подружилися з Нітратною Кислотою (цю парочку називали «Царська Горілка»), то навіть благородні метали стали їх боятися.
З ким би не зустрічалась Хлоридна Кислота (з Оксидами Металів, Гідроксидами, з Амоніаком) – усіх вона перетворювала на солі. Може, це тому, що вона дуже любила свого дідуся Натрій Хлорида на прізвисько Кухонна Сіль.
Тато Гідроген Хлорид дуже пишався своєю донькою. А вона інколи сумувала, що її ніхто не любить, і обіцяла змінити свій характер. Та всі помічали, що брати Індикатори задивляються на цю бешкетницю , незважаючи на її норов. Фенолфталеїн правда ігнорував її, а ось Лакмус І Метилоранж аж мінялися в її присутності. Лакмус ставав темно-червоним, а Метилоранж – ніжно-рожевим. Та Хлоридній Кислоті було байдуже до них.
Ніжною і доброю вона ставала тільки тоді, коли спілкувалася з мамою Водою. Тоді в неї появлялися лікувальні властивості. Вона допомагала долати проблеми при травленні їжі.
А коли Хлоридна Кислота подорослішала, то вона і порозумнішала: стала трудитися і приносити неабияку користь6 очищала парові котли від накипу, «купала « перед нікелюванням і хромуванням метали, допомагала паяти метали.
Отже темою нашого уроку є: «Хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами, основами, солями. Ряд активності металів».
Визначимо завдання на урок ( учні з допомогою вчителя ставлять завдання на урок)
ІV. Актуалізація чуттєвого досвіду учнів
 Прийом «Павучок»
Прийом «Павучок»
![]()
![]()


Завдання: скласти опорну схему все, що знають про фізичні властивості кислот
Прийом «Закінчи речення»
1. Сполука, молекула якої містить один чи декілька атомів Гідрогену, здатних під час хімічних реакцій заміщуватися на атоми металічного елемента називається …
2. За вмістом Оксигену кислоти поділяють на …
3. Частину молекули кислоти, сполучену з атомом Гідрогену, називають …
4. Кількість атомів Гідрогену в молекулі кислоти визначає …
5. Елемент, що утворює кислоту, називають …
6. Загальна формула безоксигенових кислот …
7.Кількість атомів Гідрогену в молекулі кислоти називають …
8. За хімічною активністю кислоти поділяють на …
9. Загальна формула оксигеновмісних кислот …
V. Сприйняття та усвідомлення учнями нового навчального матеріалу
1. Правила техніки безпеки під час роботи з кислотами
«Нас, кислот, запам’ятай:
«Н» спочатку, так і знай!
І як впізнаєш, що це ми,
Руки й одяг бережи!»
Розповідь вчителя:
Ми з вами повторили назви та класифікацію кислот, а зараз розпочнемо вивчення теми сьогоднішнього уроку.
Але для початку згадаємо з вами правила техніки безпеки при роботі з кислотами. ( на столах в учнів лежать інструкції з БЖД)
- Уважно читайте етикетки на склянках
- Речовини для дослідів беріть не більше 1 - 2 мл (наливайте обов'язково над лотком!)
- Не залишайте склянки з кислотами відкритими
- Не виливайте залишки реактивів з пробірки назад у склянку, з якої він був узятий
- Якщо випадково кислота потрапила на руки чи на одяг - негайно змийте її великою кількістю води, нейтралізуйте розчином соди і знову змийте водою
- Нагріваючи кислоти, користуйся тримачем, стежте, щоб стінки пробірки над рідиною не перегрілися, а рівномірно прогрівалася вся пробірка.
- Якщо потрібно розбавити сульфатну кислоту, пам'ятайте правило:
„Спочатку вода,
Потім кислота.
Інакше - трапиться біда!”
8. Категорично забороняється проводити досліди, не зазначенні в роботі, та самостійно зливати та змішувати реактиви.
2. Зміна забарвлення індикаторів в кислоті
Робота із таблицею «Зміна забарвлення індикаторів у середовищах»
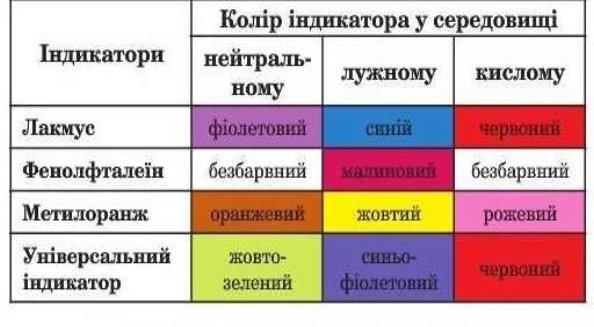
Завдання: дати відповідь на запитання
1. Індикатори це - ?
2. За допомогою яких індикаторів можна визначити кислоти.
3. На який колір індикатори змінюють своє забарвлення.
Прийом «Хімічна лабораторія»
Завдання: В три пробірки обережно налийте трохи хлоридної кислоти. Додайте до них по декілька крапель індикаторів-лакмусу, метилоранжу, фенолфталеїну. Зробіть висновки.
3. Взаємодія кислот з металами
Пояснення вчителя
Майже всі метали окиснюються кислотами. Характер взаємодії з кислотою залежить від активності металу, від його властивостей, а також від концентрації кислоти.
При взаємодії безоксигенної кислоти з металом роль окисника відіграє йон Н+. Якщо ж з металом реагує оксигеновмісна кислота, то в ролі окиснювача виступає йон Гідрогену або аніон кислотного залишку. Як розбавлена так і концентрована хлоридна кислота взаємодіє з металами, які стоять у ряді активності до водню, при цьому виділяється водень та утворюється сіль відповідного металу
Mg + HCl = MgCl2 + H2
Робота із таблицею «Ряд активності металів»

Завдання: використовуючи таблицю «Ряд активності металів», запишіть можливі рівняння реакцій. Поясніть відповідними рівняннями реакцій
Гра «Ланцюжок»
Завдання: учні по черзі називають правила техніки безпеки
Лабораторний дослід 3. Взаємодія хлоридної кислоти з металами. Проведено інструктаж з БЖД
Виконання лабораторного досліду 3. ( учні працюють із зошитами для лабораторних робіт)
Висновок:
Досліди показали, що метали за активністю витіснення водню можна розташував ти в ряд, який називається витискувальним рядом металів, або рядом активності металів. Склав його на основі експериментів учений М.М. Бекетов.
Довідка: Метали не витісняють водень з нітратної кислоти (HNO3)
4. Взаємодія кислот із основними оксидами, основами, солями
Прийом «Термінологічний словничок»
Завдання: дати визначення термінам і поняттям ( основні оксиди, основи, луги, солі, кислотні оксиди)
Робота в групах ( учні класу поділити на 3 групи)
Завдання: використовуючи підручник виконайте завдання
Група 1. Напишіть можливі реакції взаємодії кислот із основними оксидами. Зробіть висновок
Група 2. Напишіть можливі реакції взаємодії кислот із основами. Зробіть висновок
Група 3. Напишіть можливі реакції взаємодії кислот із солями. Зробіть висновок
Демонстрація. Хімічні властивості кислот
VI. Осмислення, узагальнення та систематизація знань
Повідомлення учня ( про Бекетова)
Прийом «Поетична хвилинка»
Усі кислоти, щоб ви знали,
Закохалися в метали.
Не у всі, а лише в ті,
Що під силу кислоті.
Ось погляньте на цей ряд,
Там метали всі стоять,
Гідроген між ними є,
Нам підказку він дає:
З тими, що до Гідрогену,
У кислоти нема проблеми.
У заміщення вступає –
Водень з себе виганяє.
Сіль утвориться крім того –
Це запамятай ти строго.
Микола Бекетов
Тестові завдання
1. Вкажіть кислоту, яка належить до оксигеновмісних:
а) H2SO4; б) HCl; в) H2S.
2. Серед запропонованих формул кислот вкажіть формулу сульфітної кислоти:
а) H2S; б) H2SO3; в)H2SiO3; г) H2SO4.
3. Спільне у складі кислот є присутність атомів:
а) Гідрогену; б) Оксигену; в) Нітрогену.
4. Кислоти взаємодіють із:
а) кислотними оксидами; б) основними оксидами;
в) металами, що у витиску вальному ряді розміщені після водню.
5. Вкажіть основність кислоти Н3РО4 :
а) одноосновна; б) двоосновна; в) трьохосновна; г) багатоосновна.
6. Кислоти – це сполуки, до складу яких входять:
а) атоми Гідрогену і кислотний залишок;
б) атоми металу і кислотний залишок;
в) атоми Гідрогену і атоми неметалів.
7. Яка з неорганічних кислот містить кислотний залишок ═S:
а) сульфатна; б) сульфітна; в) сульфідна?
8. Валентність кислотного залишку в кислоті H2CO3;
а) І ; б) ІІ ; в) ІІІ ; г) IV.
Завдання на встановлення відповідності
1. Вкажіть відповідність між кислотами і валентністю кислотних залишків:
а) HBr 1. ІІ
б) H2SiO3 2. ІІІ
в) H3PO4 3. І
2. Установіть відповідність між оксидом і відповідною кислотою:
Оксид Кислота
- SO2 а) HNO3
- N2O5 б) H2CO3
- CO2 в) H2SO3
Гра «Допиши рівняння»
а) ВаO + HNO3 =
б) Al2O3 + HCl =
в) BaO + H2SO4 =
г) K2O + HCl =
д) ZnO + HNO3 =
Проблемне запитання
1. Про що свідчить зміна забарвлення чайної заварки при додавання до чаю лимона?
Робота біля дошки
Завдання: складіть рівняння хімічної реакції за схемою, вкажіть тип відповідної реакції:
а) Cl2 → HCl → MgCl2
б) P→ P2O5 → H3PO4 → Zn3(PO4)2
Розв’язування задач
1.Обчисліть масу 0,5 моль сульфатної кислоти.
2. В атмосфері далекої планети була виявлена речовина, яка містить елементи: Гідроген та Хлор в масових частках 2,8% та 97,2% відповідно. Визнач хімічну формулу речовини. Дай поради мандрівникам, які збираються в подорож на цю планету щодо одягу, засобів пересування, знаряддя.
VІІ. Підведення підсумків уроку
Еккерман говорив : “Урешті решт від набутих знань в пам’яті у нас залишається тільки те, що ми застосували на практиці”. Тому я пропоную вам реалізувати отримані знання.
Завдання: дати відповідь на запитання, використовуючи метод «Прес»
1. Який безпечний спосіб визначення кислот могли б запропонувати ви?
Метод «Прес»
1. Я вважаю…
2. Тому, що….
3. Отже…..
VІІI. Повідомлення домашнього завдання
1. Опрацювати відповідний § у підручнику
2. Дати відповідь на запитання в кінці § (усно)
3. Зробити узагальнюючу опорну таблицю «Хімічні властивості кислот»
-
Чудовий урок! З його допомогою можна розвинути в дітей вміння працювати у групах!!!


про публікацію авторської розробки
Додати розробку
