Урок "Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакції заміщення. Лабораторний дослід № 2. Взаємодія хлоридної кислоти з металам
Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакції заміщення. Лабораторний дослід № 2. Взаємодія хлоридної кислоти з металами
Урок № 43 23.02
Тема: Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакції заміщення. Лабораторний дослід № 2. Взаємодія хлоридної кислоти з металами
Мета: продовжити формувати уявлення про хімічні властивості кислот, сформувати уявлення про особливості та умови взаємодії кислот з металами, дію їх на індикатори, сформувати уявлення про ряд активності металів для прогнозування можливості перебігу хімічної реакції; розвивати навички складання хімічних рівнянь реакцій; продовжити формування вмінь експериментувати, спостерігати та робити висновки; виховувати бережливе ставлення до хімічних реактивів, інтерес до хімії.
Обладнання: періодична система Д.І.Менделєєва, ряд активності металів, лабораторний посуд, хлорид на кислота, реактиви.
Тип уроку: комбінований.
Хід уроку
І. Організаційний етап
ІІ. Актуалізація опорних знань
- Робота в команді
Дано ряд кислот. Потрібно визначити зайву, та вказати за яким принципом ви її виключили.
І команда . H2S; H2CO3; H3PO4; H2SO4; H2SO3.
ІІ команда . HNO3; HCI; HBr; HI; HF.
ІІІ команда . H2CO3; H2SO4; HNO3;H2SO3; H2SiO3.
2. «Детективна історія» Справа № 3. У хімічній лабораторії нова лаборантка переплутала етикетки й на склянки з кислотами наклеїла формули відповідних оксидів. Наведіть порядок в лабораторії: напишіть формули й назви кислот, які відповідають вказаним оксидам.
SO2, N2O5, CO2, SO3.
3. Зафарбувати формули речовин відповідним кольором: солі – зеленим, основи – жовтим, кислоти – червоним, оксиди – помаранчевим
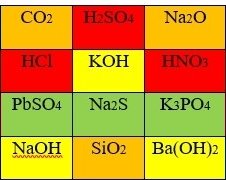
ІІІ. Мотивація навчальної діяльності
З кислотами людині приходиться стикатися все життя. Багато кислот містить наша їжа. Фрукти, овочі, молочні продукти, ліки містять цілий букет кислот: яблучну, щавлеву, лимонну, молочну, оцтову та інші. Але не тільки вдома ми стикаємось з кислотами. Якщо близько підійти до мурашника, то надовго запам’ятаєш жагучі укуси мурашок, бо вони вприскують в ранку мурашину кислоту, її ж містить і кропива. Кислоти в природі – руйнують гірські породи. Важливу роль відіграють кислоти і в організмі людини. Ортофосфатна у вигляді солей є основою кісток, зубів. Амінокислоти утворюють білок – основу життя. Хлоридна кислота входить до складу шлункового соку і сприяє травленню їжі. А більше ми дізнаємось сьогодні попрацювавши на уроці та підготувавши на наступний урок презентації.
IV. Повідомлення теми уроку
Сьогодні на уроці ми ознайомимося з властивостями кислот, згадаємо дію кислот на індикатори; ознайомимося з рядом активності металів; розглянемо реакції заміщення.
V. Вивчення нового матеріалу
1. Дія на індикатори
- Що таке індикатори?
- Які індикатори вам відомі?
- Як вони змінюють своє забарвлення у кислотах?
Давайте перевіримо ваші припущення
HCl+лакмус=червоне забарвлення
HCl+фенолфталеїн = не змінюється
HCl+метиловий оранжевий = червоне забарвлення
Отже, розчини кислот можна виявити за допомогою лакмусу і метилового оранжевого.
- Взаємодія з металами
- Чи замислювалися ви над тим, чому золоті прикраси «не бояться» води і кислот, а залізні вироби ржавіють у воді?
У багатьох хімічних реакціях беруть участь метали. Метали можуть взаємодіяти з усіма класами неорганічних сполук. Однак різні метали проявляють різну активність в хімічних взаємодіях, і від цього залежить чи буде відбуватися реакція. Чим більш активний метал, тим енергійніше він реагує з іншими речовинами.
Російський вчений Микола Миколайович Бекетов дослідив цю властивість металів та у 1863 році склад «Ряд активності металів». До речі цей російський вчений тривалий час працював в Україні в Харківському університеті.
Точкою відліку є атом неметалу Гідрогену. Якщо метал знаходиться в ряду до Н, то він буде витискувати атом Н з розчинів кислот, а ті, що після – ні.
Mg + H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Cu + H2SO4 = реакція не відбувається
- Погляньте на схеми реакцій. Що у них спільного?
Реакції заміщення – реакція між простою і складною речовиною, в результаті якої утворюється нова проста і складна речовина.
-
Виберіть рядок, який складають метали, що не витісняють водень з кислот (робота учнів з рядом активності металів):
Cu Hg Ag
Zn Mg Al
Fe Ba Ca
2. Виберіть рядок, який складають метали, що витісняють водень з кислот (робота учнів з рядом активності металів):
Zn Ba Pt
Ca Na Cr
Sr Hg Cd
3. В тваринному світі зустрічається цікавий приклад. Так, крокодил перетравлює за декілька місяців проковтнуті залізні наконечники списів і 15 см стальні гачки. Як це можна пояснити, використовуючи тему уроку?
VІ. Узагальнення і систематизація знань
- Лабораторний дослід № 2. Взаємодія хлоридної кислоти з металами
Мета: дослідити взаємодію хлоридної кислоти з металами
Хід роботи
- Ознайомлення із правилами безпеки під час роботи.
- Виконайте дослід
- Запишіть результати
- Зробіть висновок щодо взаємодії хлоридної кислоти з металами різної активності.
- Дайте відповіді на запитання:
- Яким буде забарвлення лакмусу в кислоті?
- Назвіть прізвище вченого, який вперше відкрив ряд активності металів?
- Що таке реакції заміщення?
В рівняння можливих реакцій вставте пропущене:
Mg +... HCl = Mg…. + H2↑
Au + HCl =
Zn + …HCl =……. + H2↑
Cu + HCl =
VІІ. Підбиття підсумків уроку
VІІІ. Домашнє завдання
Опрацювати параграф 30, виконати домашній експеримент на стр. 168


про публікацію авторської розробки
Додати розробку
