Урок "Хімічні властивості спиртів: повне і часткове окиснення, дегідратація, взаємодія з лужними металами та гідроген галогенідами.»
11 клас (поглиблене вивчення)
Використана навчальна програма МОН України:
Хімія. Програми для профільного навчання учнів загальноосвітніх навчальних закладів: рівень стандарту, академічний рівень, профільний рівень та поглиблене вивчення. 10-11 класи. – Тернопіль: Мандрівець, 2011.
Підручник: Хімія: підруч. для 11 кл. загальноосвіт. навч. закладів: профільний рівень/ Л.П. Величко, Н.М. Буринська. – К.: Школяр, 2013. – 384 с.: іл
План-конспект
Тема уроку:
«Хімічні властивості спиртів: повне і часткове окиснення, дегідратація, взаємодія з лужними металами та гідроген галогенідами.»
Кукса Анна Володимирівна, вчитель хімії, спеціаліст.
Запорізька спеціалізована школа І-ІІІ ступенів з поглибленим вивченням хімії та біології № 72
11 клас (поглиблене вивчення)
Використана навчальна програма МОН України:
Хімія. Програми для профільного навчання учнів загальноосвітніх навчальних закладів: рівень стандарту, академічний рівень, профільний рівень та поглиблене вивчення. 10-11 класи. – Тернопіль: Мандрівець, 2011.
Підручник: Хімія: підруч. для 11 кл. загальноосвіт. навч. закладів: профільний рівень/ Л.П. Величко, Н.М. Буринська. – К.: Школяр, 2013. – 384 с.: іл
Навчальна мета:
а) сформувати уявлення про хімічні властивості спиртів на прикладі насичених одноатомних спиртів — їх повного окиснення, взаємодії з металевим натрієм, гідроген хлоридом;
б) показати зв’язок хімічних властивостей спиртів з наявністю функціональної гідроксильної групи;
в) розглянути хімічні властивості спиртів і визначити залежність властивостей речовин від їх хімічної будови;
г) науково обґрунтувати вплив гідроксильної групи на хімічні властивості спиртів;
д) навчити розпізнавати спирти за їх хімічними властивостями.
Розвивальна мета:
а) удосконалити пізнавальні вміння: порівнювати, висловлювати припущення, виділяти головне під час спостереження, аналізувати й робити висновки;
б) розвивати творчі здібності, формувати в учнів прагнення брати активну участь у пошуку нового знання.
Виховна мета:
а) розвивати вміння й навички складати хімічні рівняння на прикладі хімічних властивостей насичених одноатомних спиртів;
б) виховувати в учнів допитливість, потребу в самостійній пошуковій діяльності;
в) формувати стійкий інтерес до вивчення предмета;
г) сформувати науковий світогляд учнів при вивченні хімічних властивостей спиртів, сприяти естетичному, екологічному вихованню.
Тип уроку: урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальна, індивідуальна, робота в малих групах, демонстраційний експеримент.
Методи: словесні, пояснювально-ілюстративні, наочні, проблемні, репродуктивні, частково-пошукові, практичні (розв’язання вправ), дослідні,
самостійної роботи, інтерактивні.
Обладнання: мультимедіа.
Основні терміни й поняття: насичені одноатомні спирти, функціональна група, загальна формула, хімічні властивості спиртів.
Міжпредметні зв’язки: екологія (чисте пальне).
Демонстрація 1. Порівняння властивостей спиртів у гомологічному ряді (горіння).
Демонстрація 2. Взаємодія етанолу з натрієм.
Демонстрація 3. Взаємодія етанолу з гідроген бромідом.
Дидактичні та методичні матеріали: мультимедійна презентація уроку, роздатковий матеріал для самостійної роботи (QR-код), демонстраційні відео-експерименти.
Структура уроку:
І. Організаційний етап (1 хв)
ІІ. Актуалізація опорних знань. Перевірка домашнього завдання (7 хв)
ІІI. Мотивація пізнавальної діяльності (2 хв)
IV. Визначення теми, мети й завдань уроку (2 хв)
V. Вивчення нового матеріалу (18 хв)
VI. Узагальнення, систематизація та закріплення знань (9 хв)
VII. Підбиття підсумків уроку, оцінювання (4 хв)
VIII. Домашнє завдання, його коментар (2 хв)
ХІД УРОКУ
- Організаційний етап
Привітання. Створення позитивного емоційного настрою, вступ до уроку
- Рада вас бачити. Сьогоднішній урок пройде під девізом:
Не просто слухати, а чути.
Не просто дивитися, а бачити.
Не просто відповідати, а міркувати.
Дружно і плідно працювати.
- Які слова є ключовими? (Слухати, бачити, міркувати, працювати)
- Актуалізація опорних знань. Перевірка домашнього завдання
- Переходимо до плідної роботи.
(Фронтальна бесіда) (Слайд 2)
- Що таке спирти?
Спирти – це похідні вуглеводнів, у молекулах яких один чи декілька атомів Гідрогену заміщені на одну чи декілька гідроксильних груп.
2. Перед вами листочки чотирилисника, під ними формула. Вам потрібно її прочитати та дати назву спирту. (СН3ОН метанол, С2Н5ОН етанол..).
3. Чи однакову розчинність у воді мають етанол і бутанол? (Ні, етанол розчиняється необмежено, а бутанол частково).
4. Які типи ізомерії притаманні спиртам? (структурна, положення гідроксильної групи, міжкласова)?
5. В чому різниця між первинним та вторинним спиртом? (У первинного спирту гідроксильна група пов’язана з атомом Карбону, який має один зв'язок з іншим атомом Карбону, а вторинний – з двома іншими атомами Карбону).
(Індивідуальна робота) (Слайд 3)
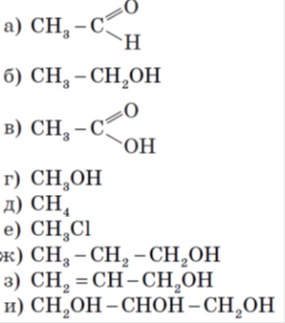
6.
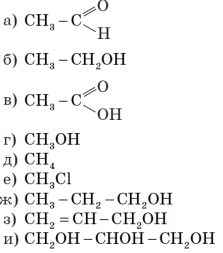
Учитель пропонує учням вибрати формули насичених одноатомних спиртів (насичені одноатомні спирти: б, г, е) і дати відповідь на питання:
1. Чому ці речовини належать до насичених одноатомних спиртів? (Є похідними насичених вуглеводнів, містять одну гідроксильну групу й відповідають загальній формулі CnH2n+1OH.)
2. Які речовини також можна віднести до спиртів? (Речовини ж, з)
3. Чому спирт з) не належить до насичених одноатомних спиртів? (Це ненасичений спирт, бо містить подвійний зв’язок.)
4. До яких спиртів належить речовина и)? (До багатоатомних)
7. Назвіть речовини за відповідними формулами: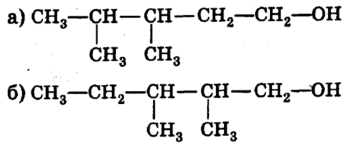
ІІІ. Мотивація навчальної діяльності
- Чи актуально для вас вивчення властивостей спиртів? (Спирти є важливими промисловими продуктами і зазнають широкого застосування як у промисловості, так і в буденному вжитку. Вони входять до складу лікарських препаратів, засобів побутової хімії та косметики. Тому нам необхідно знати властивості спиртів, щоб знати яку користь та яку шкоду вони можуть принести людині).
- Визначення теми, мети й завдань уроку
Отже, тема нашого уроку «Хімічні властивості спиртів: повне і часткове окиснення, дегідратація, взаємодія з лужними металами, гідроген галогенідами». (Слайд 4)
На сьогоднішньому уроці ми з вами розглянемо закономірності перебігу хімічних реакцій спиртів. Завдання, які потрібно виконати протягом уроку (говорять учні) (Слайд 5).
- Вивчення нового матеріалу
Вступне слово вчителя (Слайд 6)
В молекулі спиртів електронна густина зміщена до найбільш електронегативного атому Оксигену. Внаслідок чого на атомі Оксигену зосереджений частковий негативний заряд, а на атомах Карбону та Гідрогену – часткові позитивні заряди.
![]()
Тому спиртам притаманні такі типи реакцій:
- Реакції, які відбуваються з розривом зв’язку О–Н (кислотні властивості).
- Реакції, які відбуваються з розривом зв’язку С–О (основні властивості).
Хімічні властивості:
- Повне окиснення. (Учні записують назву досліду) (Слайд 7)
У лабораторній практиці етанол застосовується як пальне для спиртівок. Який висновок можна зробити про горючість етанолу? (Вони горять блакитним полум’ям з виділенням великої кількості тепла).
Демонстрація 1. Порівняння властивостей спиртів у гомологічному ряді (горіння).
- Переглянемо відео. Зверніть увагу на колір полум’я та швидкість загорання різних спиртів.
На дошці записуємо реакцію:
C2H5OH + 3O2 ![]() 2CO2 + 3H2O +1370 кДж
2CO2 + 3H2O +1370 кДж
- Який колір полум’я етанолу?
- Чому ізоаміловий спирт горить кіптявим полум’ям?
Висновок: Зі збільшення молекулярної маси одноатомних спиртів зростає світність полум’я.
- Перед вами QR-код, розшифруйте його! (робота в малих групах). (Слайд 8)

Зашифрований текст (Слайд 9). Значний досвід у виробництві і використанні паливного етанолу з відновлюваної сировини накопичений у Бразилії, США, Канаді. На заправних станціях продають суміші бензину з етанолом Е10 (10 % етанолу), Е85 (85 % етанолу), Е95 (95 % етанолу) і чистий етанол Е100. Основним виробником паливного етанолу у світі є Бразилія (12 млрд л на рік, що становить половину потреби країни у бензині і 57 % світового виробництва). Це стало можливим завдяки Національній програмі із широкомасштабного використання етанолу як автомобільного палива і субсидіям уряду, які одержали відповідну фінансову підтримку Світового банку. Весь бразильський етанол одержують із цукрової тростини ферментаційним способом.
Через високу екзотермічність реакції горіння етанолу його вважають перспективним і екологічно чистим замінником бензинового палива у двигунах внутрішнього згоряння. Поглянемо на фото такої заправки (Слайд 10).
2. Часткове окиснення (Учні записують назву досліду) (Слайд 11).
Часто використовуються окисники KMnO4, (K2Cr2O7 + H2SO4).
Первинні спирти внаслідок окиснення утворюють альдегіди, які потім легко окислюються до карбонових кислот.
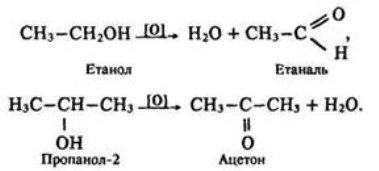
У результаті окиснення вторинних спиртів утворюються кетони.
Третинні спирти більш стійкі до дії окисників. Вони окислюються лише за жорстких умов (кисле середовище, підвищена температура), що призводить до руйнування карбонового скелета молекули й утворення суміші продуктів (карбонових кислот і кетонів з меншою молекулярною масою).
- Альдегіди та кетони ми будемо вивчати пізніше.
- У утворенням якої сполуки окиснюється етанол?
Висновок: Легкість окиснення спиртів зменшується в ряду:
первинні > вторинні >> третинні.
- Дегідратація (Учні записують назву досліду) (Слайд 12).
Відщеплення води від молекул спирту (дегідратація спиртів) залежно від умов буває внутрішньо-молекулярна або міжмолекулярна.
1. Внутрішньо-молекулярна дегідратація спиртів з утворенням алкенів перебігає в присутності концентрованої сульфатної кислоти за підвищеної температури.
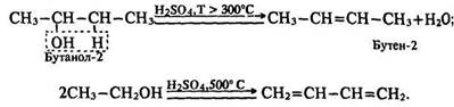
Реакція відбувається за правилом Зайцева: Гідроген відщеплюється від менш гідрогенізованого атома Карбону, що стоїть у ланцюгу поруч з атомом вуглецю, пов’язаним з гідроксигрупою. (учні записують в зошити).
2. Міжмолекулярна дегідратація спиртів з утворенням етерів відбувається за більш низької температури, ніж внутрішньо-молекулярна реакція (Слайд 13):
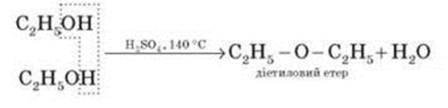
- Яку дегідратацію потрібно провести, щоб отримати диметиловий етер?
Висновок: Внутрішньо-молекулярна дегідратація спиртів призводить до утворення алкенів, а міжмолекулярна – до утворення етерів.
- Взаємодія спиртів з натрієм (Учні записують назву досліду)
Одноатомні спирти реагують з активними металами (Na, K, Mg, Al та ін.), утворюючи солі — алкоголяти.
Демонстрація 2. Взаємодія етанолу з натрієм
Переглянемо відео. Зверніть увагу на швидкість реакції взаємодії спиртів з натрієм. (Слайд 14). Самостійно запишіть рівняння реакції взаємодії етанолу з натрієм:
2C2H5ОН + 2Na → 2C2H5ОNa + H2↑
- Який спирт взаємодіє з натрієм найактивніше?
Висновок: Кислотність одноатомних спиртів зменшується в ряду:
CH3OH ![]() первинний
первинний ![]() вторинний
вторинний ![]() третинний.
третинний.
- Взаємодія з гідрогенгалогенідами (Учні записують назву досліду) (Слайд 15)
Демонстрація 3. Взаємодія етанолу з гідроген бромідом
Переглянемо відео. Зверніть увагу на агрегатний стан продукту реакції. Самостійно запишіть рівняння реакції:
С2Н5OH + HBr→ С2Н5Br + H2O
- Який агрегатний стан має бромоетан?
- Навіщо використовують концентровану сульфатну кислоту?
Висновок: Насичені одноатомні спирти взаємодіють з гідрогенбромідом.
- Узагальнення, систематизація та закріплення знань
- Використовуючи отримані на уроці знання, розв’яжемо задачу (Слайд 16): Невідомий спирт містить 52,18% Карбону, 13,04% Гідрогену та 34,78% Оксигену. Відносна густина за воднем 23. Визначте спирт.
- У результаті добування алкоголяту натрію цього спирту виділився водень об’ємом 44,8 л . Скільки г алкоголяту утворилося? (272 г.)
Розв’язок задачі (Слайд 17)
|
Дано: |
Розв’язок: |
|
W(C)= 4,35% W(H)= 13,04% W(O)= 2,17% D (Н2)= 23 Vгазу= 44,8 л
m(C2H5ONa) - ?
|
х:у:z=2:6:1 Отже, формула C2H6O або C2H5OH Для превірки використаємо: Мгазу =D*MН2 =23*2=56 г/моль Мr (C2H5OH) = 12*2+5*1+16+1=56 Отже, формула вірна.
2C2H5OH + 2Na→ 2C2H5ONa + H2 ↑
n(C2H5ONa): n(H2) = 2:1 n(H2) = 2 моль Отже, n(C2H5ONa) = 4 моль
m(C2H5ONa) = 4моль*68г/моль = 272 г |
|
Відповідь: невідомий спирт – етанол, утворилося 272 грами натрій етилату. |
|
VІІ. Підбиття підсумків уроку, оцінювання
Учні висловлюються, обираючи початок фрази із рефлексивного списку на дошці (Слайд 18).
- Сьогодні я дізнався…
- Було цікаво…
- Було складно…
- Я зрозумів, що…
- Тепер я зможу…
- Я навчився…
- У мене вийшло …
- Я зміг…
VІІI. Домашнє завдання (Слайд 19).
Високий рівень: вивчити §26, ст. 139-142, визначити невідомі речовини №6, 34 стор. 147.
Достатній рівень: вивчити §26, ст. 139-142, скласти рівняння реакцій за схемою №14, стор. 146.
Середній рівень: вивчити §26, ст. 139-142, вказати продукти дегідратації №13, стор. 146.
Творче завдання: Підготувати соціальну рекламу про негативний вплив спиртів на здоров’я людини.
Підготувати тестові завдання з теми «Хімічні властивості спиртів» за допомогою сервісу learningapps.org
Список використаних літературних джерел:
Підручник: Хімія: підруч. для 11 кл. загальноосвіт. навч. закладів: профільний рівень/ Л.П. Величко, Н.М. Буринська. – К.: Школяр, 2013. – 384 с.: іл.
Підручник для студентів вищих навчальних закладів І-II рівнів акредитації та учнів загальноосвітніх шкіл з класами поглибленого вивчення хімії / За ред. В.П. Черних. - Харків: Вид-во НфаУ; Оригінал, 2004. - 464 с.
Додатки:
QR-код

QR-код

Індивідуальне завдання:
- Скласти розгорнуту структурну формулу метанолу.
- Скласти електронну формулу етанолу.
- Скласти скорочену структурну формулу: 3,4-диметилпентан-2-ол
- Дати назву: СН3-СН2-СН2ОН.
- Масова частка Карбону в насиченому одноатомному спирті становить 64,86%. Визначте молекулярну формулу спирту.
----------------------------------------------------------------------------------------------
Індивідуальне завдання:
1. Скласти розгорнуту структурну формулу метанолу.
2. Скласти електронну формулу етанолу.
3. Скласти скорочену структурну формулу: 3,4-диметилпентан-2-ол
4. Дати назву: СН3-СН2-СН2ОН.
5. Масова частка Карбону в насиченому одноатомному спирті становить 64,86%. Визначте молекулярну формулу спирту.
6.
----------------------------------------------------------------------------------------------

В кабінет


-
Дуже цікавий матеріал. Корисний при викладанні в профільних класах. Використані новітні технології. Дякую!


про публікацію авторської розробки
Додати розробку
