Урок на тему: Хімічні властивості оцтової кислоти.
Тема уроку: Хімічні властивості оцтової кислоти
Мета: • формувати знання учнів про хімічні властивості оцтової кислоти, зумовлені карбоксильною функціональною групою; закріпити знання про хімічні властивості оцтової кислоти, спільні реакції з неорганічними кислотами та специфічні;
• розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей оцтової кислоти;
• виховувати почуття колективізму.
Тип уроку: урок формування та вдосконалення вмінь і навичок.
Форми роботи: розповідь учителя , лабораторний експеримент, робота в групах, самостійна робота учнів.
Обладнання:
• таблиці: електрохімічний ряд напруг металів, таблиця розчинності;
• хімічний посуд;
• реактиви для проведення експериментальних завдань.
І. Організаційний момент. (Об’єднання учнів у три групи )
ІІ. Актуалізація опорних знань та їх коригування.
Перевірка домашнього завдання. Перша група виконує завдання «Складіть формули», друга група у парах виконує завдання «Приготуйте розчин», третя група виконує тестові завдання на комп’ютерах. ( Додаток 1).
IІІ. Мотивація навчальної діяльності.
Слово вчителя. Оскільки наше життя складається з безперервної взаємодії хімічних речовин, в хімії важливу роль відіграє вивчення властивостей речовин, сполук, елементів. Якщо ви будете сьогодні уважні та відкриті для отримання нових знань, ми пробудимо ваш дар пророкування майбутнього, який присутній в кожного з вас.
Отже, вперед – у минуле!
ІV. Вступні завдання.
Для того, щоб перейти до вивчення нового матеріалу, ми маємо пригадати властивості неорганічних кислот на прикладі сульфатної кислоти з допомогою хімічного диктанту.
Хімічний диктант. ( Додаток 2)
Отже, якщо всі закінчили писати, перевіряємо, як ви повторили попередньо вивчений матеріал. (Діти відмічають правильні відповіді і ставлять собі оцінку в листку самооцінювання).
V. Пробні та тренувальні завдання.
Слово вчителя. Тему нашого уроку ми будемо засвоювати паралельно з виконанням лабораторних дослідів. Перед тим, як ми розпочнемо їх виконання, давайте пригадаємо, яких засобів безпеки потрібно дотримуватись під час роботи з кислотами і про що нас попереджують наступні малюнки:
1.  2.
2.  3.
3. 
Очікувана відповідь :
- Перший малюнок показує, що дана речовина є шкідливою для навколишнього середовища.
- Другий малюнок попереджує: їдка речовина.
- Третій попереджає про вогненебезпечність речовини.
Повідомлення теми й мети уроку.
( Гра «Знайди ключове слово теми» Додаток 3)
Слово вчителя: Так, це оцтова кислота. Тепер ми готові перейти до вивчення нової теми. Отже, тема нашого уроку – вивчення хімічних властивостей оцтової кислоти.
Виконання лабораторного досліду № 9. (Додаток 4)
Вивчення дії оцтової кислоти на індикатори.
Обговорення побаченого після виконання експериментів.
Слово вчителя. Отже, як ми бачимо, деякі індикатори змінюють колір під час дії на них оцтової кислоти. Які це індикатори і в який колір змінюється їх забарвлення?
Очікувана відповідь. В даному досліді колір змінили наступні індикатори:
- лакмус – змінив колір з фіолетового на червоний;
- метилоранж – змінив колір з помаранчевого на червоний;
- універсальний індикатор – змінив забарвлення з жовтого на червоний;
- фенолфталеїн – не змінив свого кольору.
Тобто, для визначення кислотного середовища оцтової кислоти можна використовувати лакмус, метилоранж та універсальний індикатори.
Виконання лабораторного досліду № 10. (Додаток 5)
Взаємодія оцтової кислоти з металами, лугами та солями.
І. Взаємодія оцтової кислоти з металами.
Слово вчителя. Як ми побачили, один метал прореагував енергійно з оцтовою кислотою, один повільно, а останній взагалі не реагує.
Питання до класу:
- Назвіть метали та поясніть, чому кожний з них взаємодіє з кислотою по-різному.
Очікувана відповідь. У першій пробірці був магній, він енергійно прореагував з оцтом, оскільки знаходиться на початку ряду напруг металів. Другим металом був цинк, він прореагував повільніше, оскільки знаходиться в ряді напруг ближче до водню, порівняно з магнієм. А третій метал – це мідь, з ним нічого не відбулося, оскільки в ряді напруг мідь розміщена після водню.
Слово вчителя. Запишіть рівняння реакцій у таблиці, не забуваючи в листках самооцінювання проставляти бали.
ІІ. Взаємодія оцтової кислоти з лугами.
Слово вчителя. Після проведення експерименту з гідроксидом натрію, ми помітили зникнення малинового забарвлення, набутого в реакції з фенолфталеїном.
Питання до класу:
- Про що свідчить знебарвлення розчину після додавання оцтової кислоти?
Очікувана відповідь. Знебарвлення розчину свідчить про проходження реакції нейтралізації між основою та кислотою.
ІІІ. Взаємодія оцтової кислоти з солями.
Слово вчителя. Побачений дослід засвідчує взаємодію оцтової кислоти з солями.
Питання до класу:
- Як ви думаєте, чи з усіма солями взаємодіятиме оцтова кислота?
- Яка ознака свідчить про проходження даної реакції?
Очікувана відповідь. Ні, оцтова кислота взаємодіє не з усіма солями, а лише з тими, чий кислотний залишок буде слабшим за її власний. Про проходження даної реакції свідчить активне виділення газу.
Слово вчителя. Запишіть всі реакції, що мали місце у лабораторних роботах, у зошити.
VI. Творчі завдання. Демонстрація хімічного експерименту.
Слово вчителя .
1. Визначте назву реактиву, який використовувався під час демонстрації. (Підказка: назва даної солі частіше за інші звучала на уроці)
2. Гра «Випробуй долю» (Додаток).
VII. Підсумки уроку. Оцінювання
VIII. Домашнє завдання
Опрацювати матеріал параграфа § 27, виконати вправу 245, с.163. Творче завдання: підготувати невелику доповідь про естери.
Додаток 1.
Перша група «Складіть формулу» оцтової та мурашиної кислоти з допомогою
роздаткового матеріалу.
Очікувана відповідь: 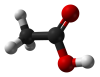 оцтова
оцтова 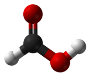 мурашина
мурашина
Друга група «Приготуйте розчин»
Для приготування 500г розчину оцтової кислоти 6% з 80% оцтової есенції необхідно взяти води та кислоти в кількостях…?
Учні третьої групи проходять тестування на комп’ютерах.
Додаток 2
Хімічний диктант.
Питання до хімічного диктанту:
1). Сульфатна кислота змінює забарвлення універсального індикатора у червоний колір. (так)
2). Кислота взаємодіє з усіма металами. (ні)
3). Дана кислота не взаємодіє з лугами. (ні)
4). При взаємодії кислоти з металами утворюється сіль і виділяється водень. (так)
5). Неорганічні кислоти взаємодіють з солями. (так)
6). Сульфатна кислота є однією з слабких кислот. (ні)
7). Взаємодія кислоти з металом називають реакцією нейтралізації. (ні)
8). Чи можлива реакція між Н2SO4 та NaCl. (ні)
9). Реакція дисоціації Н2SO4→H++SO4- написана без помилок. (ні)
10). Сульфатна кислота взаємодіє краще з магнієм ніж з залізом. (так)
Додаток 3

 Яка речовина зашифрована на малюнках.
Яка речовина зашифрована на малюнках.





про публікацію авторської розробки
Додати розробку
