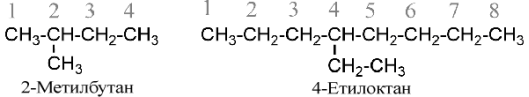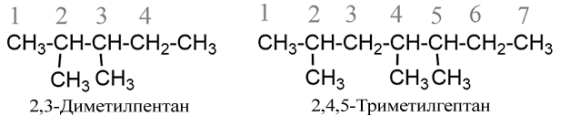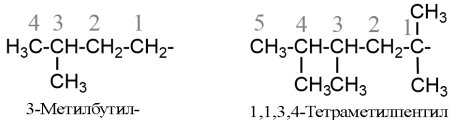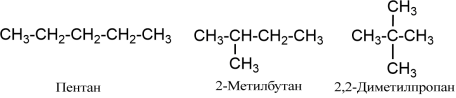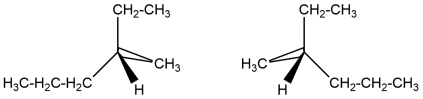Урок на тему: "Склад, властивості, застосування алканів."
Розробка уроку 10 клас за чинною навчальною програмою 2018 року. У розробці повністю та чітко розкрито тему. Урок несе в собі мету ознайомити учнів з найважливішими галузями застосування алканів; поглибити знання про поширення органічних сполук у природі; ознайомити з фізичними властивостями алканів; ознайомити з основними способами добування алканів; розвивати уміння і навички складати рівняння хімічних реакцій на прикладі реакцій добування алканів.
10 клас урок 1
Тема. Склад, властивості, застосування алканів.
Мета: ознайомити з найважливішими галузями застосування алканів; поглибити знання про поширення органічних сполук у природі; ознайомити з фізичними властивостями алканів; формувати в учнів уміння встановлювати причинно – наслідкові зв’язки між складом, будовою, властивостями та застосуванням речовин; ознайомити з основними способами добування алканів; розвивати уміння і навички складати рівняння хімічних реакцій на прикладі реакцій добування алканів.
Тип уроку: вивчення нового матеріалу.
Хід уроку
І. Актуалізація опорних знань
Фронтальна перевірка знань з вивченої теми у формі гри з кубиком.
1) Охарактеризуйте хімічну активність алканів. Чому їх у ХІХ ст. називали «хімічними мерцями»?
2) Перелічите, з чим і за яких умов реагують алкани (кожен учень називає 1 властивість і перекидає кубик наступному учню).
3) Які продукти утворюються під час горіння алканів?
4)Яку реакцію можна назвати найхарактернішою реакцією для алканів?
ІІ. Мотивація навчальної діяльності
Алкани широко застосовуються в господарській діяльності людини. Можна виділити два основні напрями використання: джерело енергії та сировина для отримання багатьох речовин. Познайомимося докладніше – де саме застосовуються алкани. Розглянемо також питання про те, де і як одержують насичені вуглеводні.
ІІІ. Вивчення нового матеріалу
Вуглеводні — органічні речовини, аліфатичні, аліциклічні та ароматичні сполуки, до складу молекул яких входять лише атоми вуглецю і водню.
Вуглеводні утворюють гомологічні ряди. У природі вуглеводні зустрічаються в рідкому, твердому і газоподібному стані. У розсіяному вигляді присутні в атмосфері, воді, (кероген), в концентрованому — у покладах вугілля, нафти, газу, газогідратів.
Ненасичені вуглеводні в природних умовах є відносно нестабільними сполуками і тому практично не зустрічаються у складі горючих корисних копалин. Серед ненасичених вуглеводнів слід зазначити продукти полімеризації ізопрену (наприклад: природний поліізопрен, терпени), що виконують в живих організмах різноманітні біологічні функції.
Алкани або аліфатичні насичені вуглеводні - сполуки з відкритим (нециклічним) ланцюгом, у молекулах яких атоми вуглецю сполучені між собою σ-зв'язком. Атом вуглецю в алканах знаходиться у стані sp3-гібридизації.
Алкани утворюють гомологічний ряд, в якому кожен член відрізняється на постійну структурну одиницю -CH2-, що називається гомологічною різницею. Найпростіший представник - метан CH4.
Загальна формула алканів: CnH2n+2
Номенклатура IUPAC
У назвах алканів використовують префікси н-, втор-, ізо, трет-, нео:
- н- означає нормальну (нерозгалужену) будову вуглеводневого ланцюга;
- втор- застосовується лише для вторинного бутилу;
- трет- означає алкіл третинної структури;
- ізо розгалуження на кінці ланцюга;
- нео використовується для алкілу з четвертинним атомом вуглецю.
Префікси ізо і нео пишуться разом, а н-, втор-, трет- через дефіс.
Номенклатура розгалужених алканів побудована заснована на таких основних правилах:
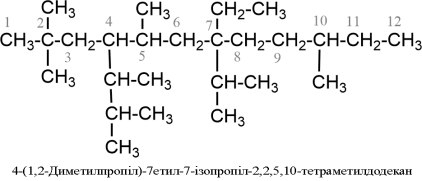
- Для побудови назви вибирають найдовший ланцюг атомів вуглецю й нумерують його арабськими цифрами (локантами), починаючи з кінця, ближче до якого розміщений замісник, наприклад:
- Якщо одна і та сама алкільна група зустрічається більше одного разу, то в назві перед нею ставлять помножуючі префікси ди- (перед голосною ді-), три-, тетра- тощо і позначають цифрою кожний алкіл окремо, наприклад:
Необхідно зауважити, що для складних залишків (груп) застосовуються помножуючі префікси на зразок біс-, трис-, тетракіс- тощо.
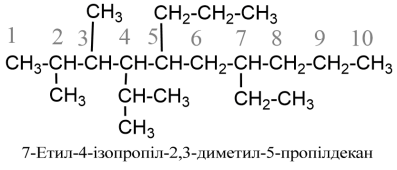
- Якщо у бокових відгалуженнях головного ланцюга розміщені різні алкіли-замісники, то їх переразовують за алфавітом (при цьому помножуючі префікси ди-, тетра- тощо, а також префікси н-, втор-, трет- не беруть до уваги), наприклад:
- Якщо можливі два або більше варіантів найдовшого ланцюга, то обирають той, який має максимальну кількість бічних розгалужень.
- Назви складніших алкільних груп будуються за тим же принципам, що і назви алканів, але нумерація ланцюга алкілу завжди автономна і починається з того атому вуглецю, який має вільну валентність, наприклад:
- При використанні в назві такої групи її беруть у дужки і в алфавітному порядку враховується вже перша літера всієї назви:
Починаючи з бутану C4H10 для алканів характерна структурна ізомерія. Кількість структурних ізомерів зростає зі збільшенням кількості вуглецевих атомів у молекулі алканів. Так, для пентану C5H12 відомо три ізомери, для октану C8H18 - 18, для декану C10H22 - 75.
Для алканів крім структурної існує конформаційна ізомерія і починаючи з гептану-енантіомерія:
Хімічні властивості алканів
Алкани в хімічному плані малоактивні речовини, через міцність міцних сигма зв’язків С-С і С-Н. При цьому зв’язки С-С неполярні, а С-Н малополярні. А так як все це малополярні види зв’язків, які відносяться до сигма виду, то розриватися вони будуть за гомолітичним механізмом, в результаті чого утворюються радикали. І як наслідок хімічні властивості алканів являють собою в основному реакції радикального заміщення.
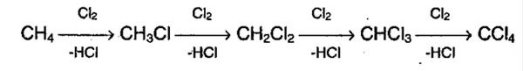
Так виглядає формула хімічної реакції радикального заміщення алканів (галогенирування алканів).
Крім цього також можна виділити такі хімічні реакції як нітрування алканів (реакція Коновалова).
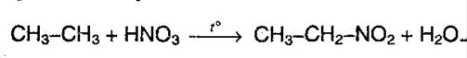
Реакція ця протікає при температурі 140 С, причому найкраще саме з третинним атомом вуглецю.
Крекінг алканів – ця реакція протікає при дії високих температур і каталізаторів. Тоді створюються умови, коли вищі алкани можуть рвати свої зв’язки утворюючи алкани нижчого порядку.
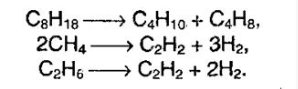
Окислення алканів – в різних умовах ця хімічна реакція може призвести до утворення спирту, альдегіду і оцтової кислоти. При повному окисленні реакція протікає аж до утворення води і вуглекислого газу
Промислові методи добування
1. Добування алканів газу. Природний газ складається головним чином з метану та невеликих домішок етану, пропану, бутану. Газ під тиском при знижених при знижених температурах розділяють на відповідні фракції.
2. Добування алканів з нафти. Сиру нафту очищують та піддають переробці (розгонка, фракціювання, крекінг). З продуктів переробки отримують суміші або індивідуальні сполуки.
3. Гідрування вугілля (метод Ф. Бергіуса, 1925 р.). Кам'яне або буре вугілля в автоклавах при 30 МПа у присутності каталізаторів (оксиди та сульфіди Fe, Mo, W, Ni) в середовищі вуглеводнів гідруються і перетворюються в алкани, так зване моторне паливо:
nC + (n+1)H2 = CnH2n+2
4. Оксосинтез алканів (метод Ф. Фішера - Г. Тропша, 1922 р.). За методом Фішера - Тропша алкани одержують з синтез-газу. Синтез газ являє собою суміш CO та H2 з різним співвідношенням. Його отримують з метану однією з реакцій, які відбуваються при 800-900°C в присутності оксиду нікелю NiO, нанесеного на Al2O3:
CH4 + H2O ⇄ CO + 3H2
CH4 + CO2 ⇄ 2CO + 2H2
2CH4 + O2 ⇄ 2CO + 4H2
Алкани отримують за реакцією (температура близько 300°C, каталізатор Fe-Co):
nCO + (2n+1)H2 → CnH2n+2 + nH2O
Утворена суміш вуглеводнів, яка складається в основному з алканів будови (n=12-18), називають "синтином".
5. Суха перегонка. У відносно невеликих кількостях алкани одержують за допомогою сухої перегонки або нагрівання вугілля, сланців, деревини, торфу без доступу повітря. Приблизний склад отриманої суміші при цьому становить 60% водню, 25% метану та 3-5% етилену.
Лабораторні методи добування
1. Одержання з галогеналкілів
1.1. Взаємодія з металічним натрієм (Вюрц, 1855 р.). Реакція полягає у взаємодії лужного металу з галогеналкілом та застосовується для синтезу вищих симетричних алканів:
2CH3-I + 2Na ⇄ CH3-CH3 + 2NaI
У разі участі у реакції двох різних галогеналкілів утворюється суміш алканів:
3CH3-I+3CH3CH2-I+6Na→CH3-CH3+CH3CH2CH3+CH3CH2CH2CH3+6NaI
1.2 Взаємодія з літійдіалкілкупратами. Метод (інколи називають реакцією Е. Корі - Х. Хауса) полягає у взаємодії реакційноздатних літійдіалкілкупратів R2CuLi з галогеналкілами. Спочатку відбувається взаємодія металічного літію з галогеналканом у середовищі етеру. Далі відповідний алкіллітій реагує з галогенідом міді(I) з утворенням розчинного літійдіалкілкупрату:
CH3Cl + 2Li → CH3Li + LiCl
2CH3Li + CuI → (CH3)2CuLi + LiI
При взаємодії такого літійдіалкілкупрату з відповідним галогеналкілом утворюється кінцева сполука:
(CH3)2CuLi + 2CH3(CH2)6CH2-I → 2CH3(CH2)6CH2-CH3 + LiI + CuI
Метод дозволяє досягти виходу алканів майже 100% при застосуванні первинних галогеналкілів. При їх вторинній або третинній будові вихід складає лише 30-55%. Природа алкільної складової в літійдіалкілкупраті мало впливає на вихід алкану.
1.3 Відновлення галогеналкілів. Відновлювати галогеналкіли можливо каталітично збудженим молекулярним воднем, атомарним воднем, йодоводнем тощо:
CH3I + H2 → CH4 + HI (каталізатор Pd)
CH3CH2I + 2H → CH3CH3 + HI
CH3I + HI → CH4 + I2
Метод має препаративне значення, часто використовують сильний відновник - йодоводень.
2. Одержання з солей карбонових кислот.
2.1 Електроліз солей (Кольбе, 1849 р.). Реакція Кольбе полягає в електролізі водних розчинів солей карбонових кислот:
R-COONa ⇄ R-COO-+ Na+
На аноді аніон карбонової кислоти окиснюється, утворюючи вільний радикал, і легко декарбоксилюється чи відщеплює CO2. Алкільні радикали далі внаслідок рекомбінації перетворюються в алкани:
R-COO- → R-COO• + e-
R-COO• → R• + CO2
R• + R• → R-R
Препаративний метод Кольбе вважається ефективним при наявності відповідних карбонових кислот і неможливості застосувати інші методи синтезу.
2.2 Сплавляння солей карбонових кислот з лугом. Солі лужних металів карбонових кислот при славленні з лугом утворюють алкани:
CH3CH2COONa + NaOH → Na2CO3 + CH3CH3
3. Відновлення кисневмісних сполук (спиртів, кетонів, карбонових кислот). Відновниками виступають вищезгадані сполуки. Найчастіше застосовують йодоводень, який здатен відновлювати навіть кетони:
R-OH + 2HI → R-H + I2 + H2O
CH3-CO-CH3 + 4HI → CH3-CH2-CH2 + 2I2 + H2O
У препаративному плані часто використовують відновлення карбонільних сполук за Е. Клемменсеном та М. Кіжнером.
4. Гідрування ненасичених вуглеводнів. Реакція гідрування ненасичених сполук широко застосовується при переході від одного класу вуглеводнів до іншого:
CH3-CH=CH2 + H2 → CH3-CH2-CH3 (каталізатор Pt, Ni)
CH≡CH + 2H2 → CH3-CH3 (каталізатор Pt, Ni)
Реакції гідрування показують генетичний зв'язок між насиченими і ненасиченими сполуками та можливість їх взаємного переходу одні в інші.
Застосування алканів
- Газоподібні алкани (С1 – С4) використовують як паливо (метан або пропан – бутанова суміш).
- Рідкі вуглеводні використовують як моторне паливо, як розчинники.
- Метан є сировиною для добування водню, сажі, ацетилену, багатьох органічних речовин.
- Вазелінова олія (до С15) використовується у медицині, парфумерії, косметиці.
- Вазелін (до С25) – основа для виготовлення лікувальних мазей.
- Парафін (С18 – С35) використовується у медицині (парафінотерапія), виготовляють свічки.
- Озокерит, або горний віск - використовується у медицині для лікувальних теплових процедур.
- Алкани – сировина для одержання пластмас, канчуків, синтетичних волокон, мийних засобів та інших речовин.
- Застосовуються галогенпохідні алканів:
СН3Cl – у холодильних установках. У медицині для місцевої анестезії.
СН2Сl2, СНСl3, ССl4 – розчинники.
ІV. Закріплення набутих знань
Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
С2Н2
↑
С → СН4 → СН3Cl → C2H6 → C2H5Br →С4Н10 → СО2
↑ ↓
CH3COONa СО2
V. Підведення підсумків уроку.
VІ. Домашнє завдання


про публікацію авторської розробки
Додати розробку