Розробка уроку на тему: "Оксигеновмісні органічні речовини. Спирти. Склад, властивості, використання."
Метою уроку є формування в учнів уявлення про оксигеновмісні органічні сполуки; формувати знання учнів про метанол, етанол і гліцерин як органічні сполуки, що містять функціональну гідроксильну групу; ознайомити учнів з молекулярними, електронними та структурними формулами спиртів, фізичними властивостями, зумовленими наявністю функціональної гідроксильної групи, застосуванням та використанням спиртів.
Тема: Оксигеновмісні органічні речовини. Спирти. Склад, властивості, використання.
Мета уроку: формувати в учнів уявлення про оксигеновмісні органічні сполуки; формувати знання учнів про метанол, етанол і гліцерин як органічні сполуки, що містять функціональну гідроксильну групу; ознайомити учнів з молекулярними, електронними та структурними формулами спиртів, фізичними властивостями, зумовленими наявністю функціональної гідроксильної групи, застосуванням та використанням спиртів.
Тип уроку: вивчення нового матеріалу.
Хід уроку
I. Організація класу
II. Актуалізація опорних знань. Мотивація навчальної діяльності
Фронтальна бесіда
1) Які хімічні елементи найчастіше містяться в складі органічних сполук?
2) На які класи поділяють вуглеводні?
3) Наведіть приклади відомих вам органічних сполук, що містять Оксиген, Нітроген та інші хімічні елементи.
IІІ. Вивчення нового матеріалу
Органічні сполуки, що містять у своєму складі атоми Оксигену, називаються оксигеновмісними.
Оксиген, як правило, входить до складу органічних сполук у вигляді груп атомів. Такі групи атомів називають функціональними групами.
Функціональні групи – це групи атомів, що визначають хімічні й фізичні властивості речовин.
Наприклад:
-OH – гідроксильна група;
-COH – карбонільна;
-COOH – карбоксильна.
До складу сполук може входити одна або кілька функціональних груп (однакових або різних).
Органічні речовини, молекули яких містять одну або кілька функціональних гідроксильних груп, з’єднаних з вуглеводнями, називаються спиртами.
Спирти — це похідні вуглеводнів, у молекулах яких один або декілька атомів Гідрогену заміщені на гідроксигрупу.
Гідроксигрупа —OH є функціональною групою спиртів, яка визначає їхні властивості.
Загальна формула спиртів – R(OH)n. Якщо у формулі n = 1, то такі спирти називають одноатомними, наприклад C2H5OH – етанол. Значенню n = 2 відповідають двоатомні спирти, наприклад CH2OH–CH2OH – етиленгліколь, або етандіол-1,2, а значенню n = 3 – триатомні спирти, наприклад гліцерол, або пропантріол-1,3 CH2OH–CH(OH) –CH2OH.
Фізичні властивості. Метанол CH3OH – безбарвна рідина з температурою плавлення -97,9 °С та температурою кипіння 64,5 °С, густиною 0,7917 г/мл, легко змішується з водою в будь-якому співвідношенні.
Етанол CH3–CH2OH – безбарвна рідина з t = -114,15°С та t = 78,4 °С, густиною 0,7935 г/мл, розчиняється у воді й органічних розчинниках.
Гліцерол HOCH2CH(OH)CH2OH – безбарвна масляниста рідина без запаху, має солодкий смак, t = -17,9°С, t = 290 °С, густина 1,2604 г/мл, гігроскопічна речовина.
Хімічні властивості. У функціональній групі OJH хімічний зв’язок O–H є полярним, атом Гідрогену в ній досить рухливий, тобто здатний заміщуватися.
Спирти можуть виявляти кислотні властивості. Підтвердженням цього є здатність спиртів взаємодіяти з металами, причому найактивніше з лужними:
![]()
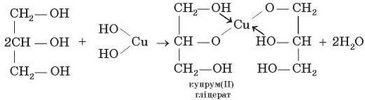
Зі збільшенням кількості гідроксигруп у молекулах спиртів рухливість їхніх атомів Гідрогену зростає. Тому, на відміну від одноатомних спиртів, багатоатомні спирти, зокрема гліцерол, виявляють сильніші кислотні властивості: вони здатні взаємодіяти навіть з досить слабкою основою купрум(ІІ) гідроксидом:
Метанол, етанол та гліцерол вступають у реакції повного окиснення, унаслідок яких утворюються карбон (ІV) оксид і вода:
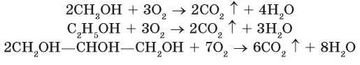
Хімічні властивості багатоатомних спиртів (на прикладі гліцерину).
1) Горіння:
2С3Н5(ОН)3 + 7О2 = 6СО2 + 8 Н2О
Утворюються вуглекислий газ і вода (за достатньої кількості кисню).
2) Взаємодія з активними металами (може відбуватися ступінчасто):
2С3Н7(ОН)3 + 2Na = 2С3Н5(ОН)2 ONa (натрій пропантріолят)+ Н2
2С3Н5(ОН)3 + 2Na = 2С3Н5(ОН) (ONa)2 (динатрій пропантріолят)+ Н2
2С3Н5(ОН)3 + 3Na = 2С3Н5(ONa)3 (тринатрій пропантріолят)+ 3Н2
3) Взаємодія з галогеноводнями (може відбуватися ступінчасто):
С3Н5(ОН)3 + 3НCl = 2С3Н5Cl3 (1,2,3-трихлорпропіл)+ Н2О
4) Нітрування (нітруюча суміш – суміш концентрованих нітратної і сульфатної кислот):
С3Н5(ОН)3 + 3НО-NO2 = 2С3Н5(ONO2)3 (нітрогліцерин (гліцерин тринітрат))+ Н2О
Нітрогліцерин – вибухова речовина, вибухає від легкого струсу і нагрівання.
Із нітрогліцерину виробляють динаміт.
5) Взаємодія з купрум(ІІ) гідроксидом(якісна реакція на багатоатомні спирти):
Купрум(ІІ) гліцерат, що утворюється, — розчин синього кольору.
Методи добування спиртів
1. Гідратація алкенів. При взаємодії алкенів з водою в присутності мінеральних кислот (сульфатної, фосфатної) утворюються спирти. Мінеральні кислоти виконують роль каталізаторів і є джерелом протонів:
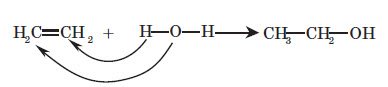
2. Гідроліз галогенопохідних алканів водним розчином лугів:
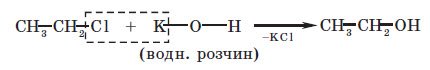
3. Відновлення альдегідів у присутності каталізаторів:
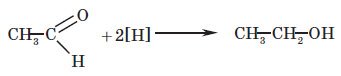
4. Етиловий спирт можна добувати спиртовим бродінням вуглеводів (глюкози) під впливом ферменту зимази спиртових дріжджів:
![]()
Хімічні властивості спиртів
1. Горіння.
При збільшенні кількості атомів Карбону в молекулі спиртів поряд з реакцією повного згорання спиртів може відбуватися реакція неповного згорання з виділенням сажі (вуглецю), що призводить до збільшення світління полум’я. Виділення різних продуктів (CO2 та C) пояснює явище яскравого полум’я, що коптить.
Повне згорання (достатня кількість кисню):
![]()
Неповне згорання з виділенням чадного газу (нестача кисню):
![]()
Неповне згорання з виділенням сажі (нестача кисню):
![]()
2. Взаємодія спиртів з лужними металами.
Атоми активних металів витісняють атоми Гідрогену гідроксильної групи з утворенням алкоголятів та газоподібного водню:
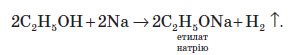
3. Взаємодія спиртів з галогеноводнями:
![]()
4. Дегідратація.
Процес дегідратації може відбуватися двома різними способами: за участю однієї молекули спирту та двох молекул спирту.
4.1. Внутрішньомолекулярна дегідратація:
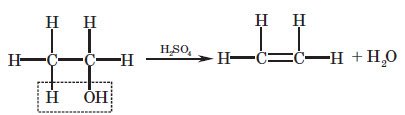
4.2. Міжмолекулярна дегідратація:
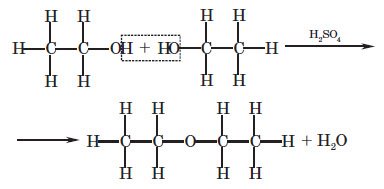
Застосування спиртів
Спирти використовують як органічні розчинники, як паливо для двигунів (добавка метилового й етилового спиртів сприяє повноті згорання й запобігає забрудненню атмосфери).
Метанол застосовують у виробництві формальдегіду, використовують як добавку до моторного палива для підвищення його октанового числа.
Етанол використовують для одержання синтетичного каучуку, барвників, оцтової кислоти, бездимного пороху, у виробництві пластмас, як розчинник під час виготовляння одеколонів, ліків, як паливо у двигунах внутрішнього згорання; у медичній практиці — як зовнішній антисептичний засіб для дезінфекції рук та хірургічних інструментів.
Гліцерол використовують у виробництві вибухових речовин, як пом’якшувач тканин, шкіри, паперу, компонент мастил, кремів для взуття, мила, клеїв, у косметиці, кондитерських виробах.
Отруйність спиртів, їх згубна дія на організм людини. Метанол — дуже отруйна речовина, через те що в організмі людини він окиснюється до мурашиної кислоти. Уживання навіть невеликої кількості метанолу призводить до втрати зору, а потім до смерті.
Етанол швидко всмоктується в кров і збуджувально діє на організм людини, а також сильно уражає центральну нервову систему. Тому вживання етанолу у великих дозах може призвести до смерті.
Гліцерол — гігроскопічна, солодка на смак рідина, неотруйна, легко засвоюється організмом.
V. Первинне застосування отриманих знань
Зобразіть структурну формулу гліцерину.
Спирти — речовини молекулярної будови, а отже, мають низькі температури кипіння й плавлення, легколеткі, мають запах.
Знайдіть у підручнику або довідковій літературі температури кипіння й плавлення метанолу, етанолу, гліцерину.
V Підбиття підсумків уроку
VІ. Домашнє завдання
-
Дякую.

про публікацію авторської розробки
Додати розробку
