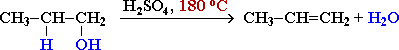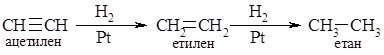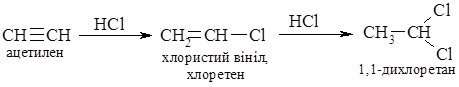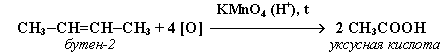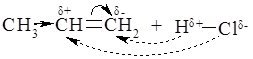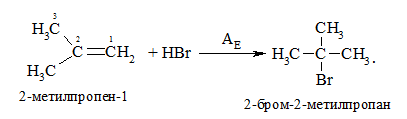Розробка уроку на тему: "Етилен і ацетилен. Склад, властивості та застосування."
Цілі уроку - формувати знання учнів про гомологічні ряди алкенів і алкінів на прикладі етилену й ацетилену; ознайомити учнів із природою кратного зв'язку, новими видами ізомерії — ізомерією положення кратного зв'язку, міжкласовою ізомерією; удосконалювати навички й уміння складати структурні формули й давати назви органічним сполукам на прикладі алкенів і алкінів; ознайомити з фізичними властивостями етилену й ацетилену; показати зв'язок їх будови та властивостей.
Тема уроку. Етилен і ацетилен. Склад, властивості та застосування.
Цілі уроку: формувати знання учнів про гомологічні ряди алкенів і алкінів на прикладі етилену й ацетилену; ознайомити учнів із природою кратного зв’язку, новими видами ізомерії — ізомерією положення кратного зв’язку, міжкласовою ізомерією; удосконалювати навички й уміння складати структурні формули й давати назви органічним сполукам на прикладі алкенів і алкінів; ознайомити з фізичними властивостями етилену й ацетилену; показати зв’язок їх будови та властивостей.
Тип уроку: комбінований урок засвоєння знань.
Хід уроку
І. Перевірка домашнього завдання. Актуалізація опорних знань
Фронтальна перевірка знань з вивченої теми.
1) Охарактеризуйте сферу застосування ацетилену?
2) Перелічите, з чим і за яких умов реагують алкіни (кожен учень називає 1 властивість і перекидає кубик наступному учню).
3) Чому гомологічні ряди алкенів і алкінів починаються з вуглеводнів, що містять два атоми Карбону, а не один, як в алканів?
(За загальною формулою виходять формули речовин CH2 і CH0, що не відповідає валентності Карбону)
ІІ. Мотивація навчальної діяльності
Однією з причин різноманіття органічних сполук є міжкласова ізомерія — явище існування ізомерів з різних класів органічних сполук. Наприклад, для алкенів міжкласовими ізомерами будуть циклоалкани: бутен — циклобутан.
Для алкінів міжкласовими ізомерами будуть, наприклад, органічні сполуки, що містять два подвійні зв’язки.
ІІІ. Вивчення нового матеріалу
Вуглеводні поділяють на дві великі групи: на вуглеводні з відкритим ланцюгом вуглецевих атомів, які називають аліфатичними, і на вуглеводні з замкненим ланцюгом, які називають циклічними.
Аліфатичні вуглеводні, у свою чергу, поділяють на дві підгрупи: на насичені вуглеводні, в молекулах яких атоми вуглецю зв’язані між собою лише простими одинарними зв’язками, і на ненасичені вуглеводні, в молекулах яких між атомами вуглецю є подвійні і потрійні зв’язки.
Алкенами називають вуглеводні, в молекулах яких міститься один подвійний зв’язок С=С.
Їх також називають етиленовими вуглеводнями, або олефінами. Назва олефін (від франц. gaz olefiant - олієподібний газ) виникла ще в XVIII ст. від назви оліїстої на вигляд сполуки СН2С1-СН2СІ - “олії голландських хіміків”, що була отримана при взаємодії етилену з хлором.
Алкени утворюють гомологічний ряд формули СnН2n. Родоначальник ряду - етен (етилен) СН2=СН2.
Методи одержання алкенів
Промислові методи
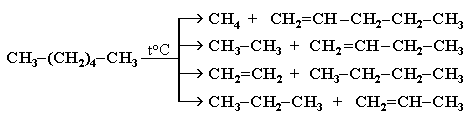
1. Крекінг алканів нафти
Лабораторні методи
1. Дегідратація спиртів:
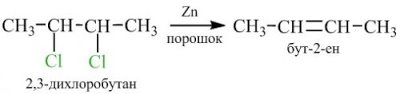
2. Відщеплення галогенів від дигалогенопохідних алканів:
3. Гідрування алкінів:
Хімічні властивості алкенів
1. Реакція гідрування:
2. Реакція Вагнера (окиснення перманганатом Калію у лужному середовищі):
3. Реакції окиснення перманганатом Калію у кислому середовищі:
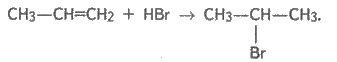
4. Реакції приєднання галогеноводнів:
Правило Марковнікова: У результаті приєднання галогеноводнів до несиметричних алкенів Гідроген приєднується до найбільш гідрогенізованого атому Карбону.
5. Реакції приєднання галогенів:
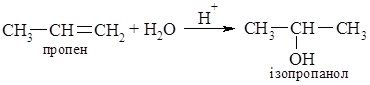
6. Реакції приєднання води (за правилом Марковникова):
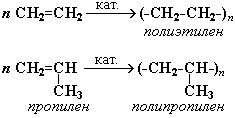
7. Реакції полімеризації
Алкіни - вуглеводні, в молекулах яких є два атоми вуглецю, сполучені потрійним зв'язком - С º С -. Алкіни називають також ацетиленовими вуглеводнями.
Найпростішім алкіном є ацетилен, або етин:
![]()
Розглянемо природу зв¢язків у молекулі ацетилену згідно з електронною теорією. Підчас утворення хімічних зв¢язків у молекулі ацетилену гібридизації зазнають тільки дві орбіталі зовнішнього енергетичного рівня атома вуглецю: одна s- і одна р- орбіталь. Цей тип гібридизації називається sp-гібридизацією. Дві р- орбіталі вуглецевого атома залишаються в незмінному вигляді.
Потрійний зв’язок у молекулі ацетилену складається з одного s- і двох p- зв’язків. Постійний зв’язок міцніший, ніж подвійний, а відстань між вуглецевими атомами в ацетилені менша, ніж в етилені.
Ацетилен С2Н2 - перший член гомологічного ряду. Формули наступних алкінів одержують додаванням до формули ацетилену гомологічної різниці СН2: С3Н4, С4Н6 і т.д.
Назви алкінів за міжнародною номенклатурою утворюють з назв алканів з тим самим числом атомів вуглецю, замінюючи закінчення -ан на -ін (-ин). Приклади:

Назви алкінів з розгалуженим ланцюгом і структурних ізомерів алкінів, які утворюються внаслідок різного положення потрійного зв¢язку в ланцюгу і бічних замісників, будують аналогічно до назв складних алкенів; цифра в кінці назви означає найменший номер атома вуглецю ланцюга, який находиться біля потрійного зв¢язку.
Приклади:
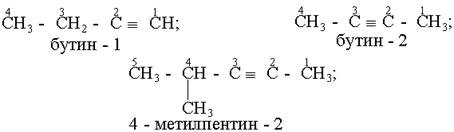
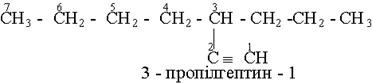
Загальна формула гомологічного ряду алкінів СnН2n -2 - , де п = 2,3,4,5… .
Властивості. Ацетилен - це безбарвний газ без запаху, температура кипіння - 83,8°С. Розчинний у воді. Технічний ацетилен має неприємний запах, зумовлений наявністю домішок.
Як і алкени, ацетилен легко вступає в реакції приєднання і окислення. Крім того, для алкінів характерні реакції заміщення водню, сполученого з атомом вуглецю біля потрійного зв'язку.
1. Гідрування. Алкіни приєднують водень при наявності каталізаторів з утворенням алканів або алкенів (неповне гідрування). Так, якщо як каталізатор застосовують нікель або платину, то при гідруванні ацетилену утворюється насичена сполука етан, а з каталізатором паладій або залізо - етилен:
![]()
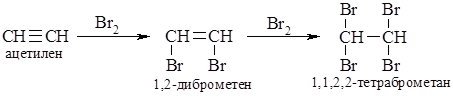
2. Галогенування. Алкіни легко приєднують хлор і бром. Реакція відбувається в дві стадії:
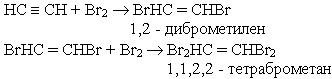
Як і етилен, ацетилен знебарвлює бромну воду. Ця реакція є якісною на ацетилен на інші алкіни.
3. Гідрогалогенування. Процес приєднання галогеноводнів до алкінів відбувається легко в дві поділимі стадії. На першій стадії утворюється галагенопохідна алкену, на другій до цієї похідної приєднується друга молекула галогеноводню згідно з правилом Марковникова:
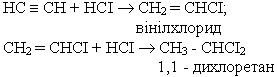
4.Гідратація. Ацетилен та його гомологи гідратуються при наявності каталізаторів - солей ртуті (ІІ) HgSO4 або Hg(NO3)2. При гідратації ацетилену утворюється оцтовий альдегід:
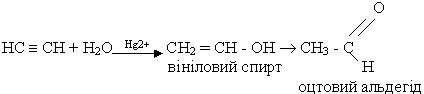
Взаємодія відбувається через стадію утворення нестійкої сполуки - вінілового спирту, який піддається изомерізації в стійку сполуку - оцтовий альдегід. Цю реакцію відкрив російський вчений М.Г.Кучєров у 1881 р. Вона лежить в основі промислового добування оцтового альдегіду.
5. Окислення. Алкіни легко окислюються. Так, вони знебарвлюють розчин перманганату калію:
![]()
Цю реакцію використовують як якісну на потрійний зв’язок.
6. Реакції заміщення. Водень, сполучений з атомом вуглецю біля потрійного зв'язку, дуже рухливий, внаслідок чого для ацетилену та його гомологів характерні реакції заміщення. Наприклад, ацетилен та його гомологи які містять потрійний зв’язок біля першого атома вуглецю, взаємодіють з аміачними розчинами гідроксидів або солей срібла і міді (І):
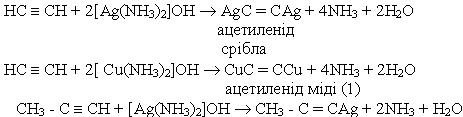
До похідних ацетилену ацетиленідів металів - належить карбід кальцію СаС2 структура якого містить потрійні зв’язки вуглець - вуглець.
Добування. Для добування ацетилену в лабораторних умовах використовують реакцію карбіду кальцію з водою:
![]()
У промисловості ацетилен добувають з технічного карбіду кальцію або метану при нагріванні:
![]()
Гомологи ацетилену можна добути з дигалогенопохідних алканів, діючи на них спиртовим розчином лугу, наприклад:
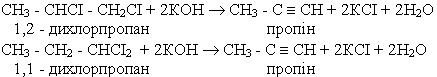
Застосування. Ацетилен є вихідною сировиною для багатьох органічних синтезів. У хімічній промисловості його застосовують для добування оцтового альдегіду і оцтової кислоти, вінілхлориду та інших речовин.
ІV. Закріплення набутих знань
Тренувальні вправи
1. Напишіть структурні формули речовин (по ланцюжку біля дошки):
а) етен; б) етин;
в) пропен; г) пропін;
д) 2-метил-1-бутен; е) 3-метил-1-бутин.
2. Самостійна робота під керівництвом учителя з наступною усною перевіркою
Складіть формули двох гомологів для речовин:
а) CH ≡ CH
б) CH2 = CH − CH2 − CH3
Складіть формули ізомерів, дайте їм назви:
а) C4 H8;
б) C5 H8.
V. Підведення підсумків уроку.
VІ. Домашнє завдання

про публікацію авторської розробки
Додати розробку