Урок на тему "Взаємодія води з оксидами. Поняття про кислоти й основи.Поняття про індикатори.
Урок № 7 Клас
Тема: Взаємодія води з оксидами. Поняття про кислоти й основи. Поняття про індикатори.
Мета: ознайомити учнів з хімічними властивостями води, а саме із взаємодією з оксидами; дати поняття що таке оксиди, кислоти, основи та індикатори;
розвивати вміння писати рівняння реакцій, аналізувати хімічні процеси; виховувати почуття взаємодопомоги та інтерес до вивчення хімії.
Тип уроку: вивчення нового матеріалу .
Форми роботи: фронтальна бесіда, розповідь вчителя, тести, лабораторні досліди, завдання на картках.
Обладнання: підручник хімія 7 клас, періодична система хімічних елементів Д.І. Менделєєва, штатив з пробірками, розчини кислот і лугів, індикатори, склянки з водою.
Хід уроку
І. Організаційний момент.
(Діти вибирають один із смайликів, який відповідає їхньому настрою на початку уроку)

ІІ. Перевірка домашнього завдання.
- Що таке масова частка розчиненої речовини? Пригадайте формулу для знаходження масової частки розчиненої речовини.
Закінчіть рівняння реакцій:
Р + О2 →
Са + О2 →
С + О2 →
Na + О2 →
Розв’язання задач по карточкам.
- Калій хлорид масою 30 г розчинили у воді масою 120 г. Яка масова частка калій хлориду у добутому розчині?
Дано: Розв’язання:
m (КCl) = 30 г 1. Яка маса розчину?
m (H2O) = 120 г ![]()
w (KCl) - ? 2. Яка масова частка калій хлориду в
розчині?
![]()
Відповідь: w (KCl) = 20%
- Обчисліть масову частку хлоридної кислоти у розчині, одержаному розчиненням 33,6 л гідрогенхлориду в 245,25 г води (н.у.).
Дано: Розв’язання:
V (НCl) = 33,6 л 1. Яка кількість речовини гідрогенхлориду?
m (H2O) = 245,25 г ![]()
w(НCl) - ? 2. Яка маса гідрогенхлориду?
![]()
3. Яка маса утвореного розчину?
![]()
4. Яка масова частка гідрогенхлориду в розчині?
![]()
Відповідь: w (НCl) = 18,25%
III. Мотивація навчальної діяльності.
Діти, Ви вже знаєте, що вода може реагувати з багатьма речовинами. Сьогодні на уроці ми з вами познайомимося із взаємодією води з оксидами неметалів. Поняття про індикатори. Ми разом з вами навчимося складати рівняння реакцій взаємодії води з оксидами неметалів. Узнаємо, які речовини називаються кислотами, основами, що таке індикатори.
IV. Вивчення нового матеріалу.
План.
- Взаємодія води з оксидами.
- Поняття про кислоти.
- Поняття про основи.
- Поняття про індикатори.
1. Взаємодія води з оксидами.
Діти ви вже знаєте, що вода здатна вступати в хімічні реакції з багатьма речовинами як простими так і складними. Однією з найважливіших є реакція води з оксидами. Давайте з вами з’ясуємо, що ж таке оксиди?
Отже, оксиди – це складні речовини (або бінарні сполуки), утворені двома елементами, один з яких Оксиген. В оксидах хімічний елемент Оксиген має валентність ІІ, ступінь окиснення −2.
За можливими валентностями елементів від 1 до 8, відомо 8 типів оксидів: Е2О, ЕО, Е2О3, ЕО2, Е2О5, ЕО3, Е2О7, ЕО4.
Назви оксидів складаються із двох слів: перше – назва елемента, друге – оксид. Якщо елемент має змінну валентність та утворює декілька оксидів, то валентність елемента зазначається в дужках римською цифрою після назви елемента.).
Діти як ви думаєте, які бувають оксиди? Давайте з вами з’ясуємо разом, тому записуємо в зошиті таку табличку.
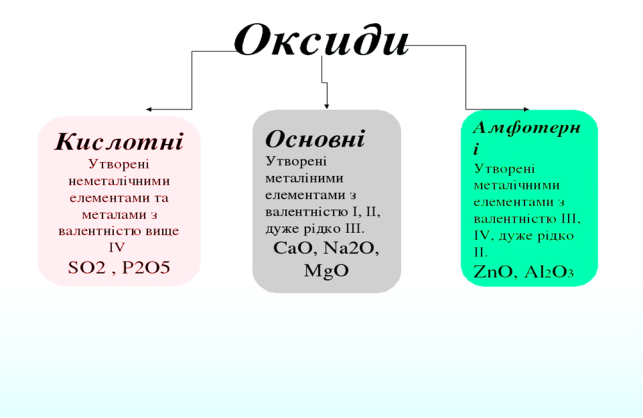
Приклад оксидів:
H2O — гідроген оксид або вода.
На Землі вода зустрічається у всіх трьох агрегатних станах — газоподібному (водяна пара), рідкому і твердому (лід, сніг).
А зараз діти ми з вами разом зробимо і заповнимо табличку про фізичні властивості води:
Фізичні властивості води
|
Колір |
Безбарвна |
|
Смак, запах |
Без смаку і запаху |
|
Агрегатний стан |
Існує в трьох агрегатних станах: рідина, газ, тверда речовина |
|
Температура кипіння |
100◦С |
|
Температура замерзання |
0◦С |
|
Тепло- та електропровідність |
Погана |
Зараз ми з вами діти проведемо лабораторний дослід, але перед початком досліда ми з вами повторимо правила техніки безпеки!
Правила техніки безпеки!
Вручити дітям інструкції – пам’ятки.
1. Будьте максимально обережні, виконуючи роботу.
2. Виконуйте лише ті досліди, які описані в інструкції
3. Під час роботи з кислотами бережи очі. У разі потрапляння кислоти на руки слід негайно змити її великою кількістю води та обробити уражене місце натрій гідроген карбонатом.
4. Уважно читайте етикетку на банці з речовиною, яку берете для досліду.
5. Відкривши банку, не кладіть пробку на лабораторний стіл, а поставте її.
6. Наливаючи рідину, посудину з реактивом беріть так, щоб етикетка була направлена в бік долоні, знімайте краплю з краю шийки, інакше рідина стікатиме по склу, псуватиме етикетку й може пошкодити шкіру рук.
7. Нагріваючи кислоти, користуйся тримачем, стежте, щоб стінки пробірки над рідиною не перегрілися, а рівномірно прогрівалася вся пробірка.
8.Не зазирайте в пробірку, в якій нагрівається рідина і не нахиляйся над посудиною, в яку наливають будь – яку рідину, тому, що найдрібніші краплі можуть потрапити в очі.
9.Посудину, з якої взяли реактив, відразу ж закрийте й поставте на місце.
10.Розбавляючи кислоту, її слід лити тонкою цівкою у воду.
11. У разі потрапляння кислоти на руки або обличчя шкіру необхідно
промити проточною водою, а потім 3 % розчином питної соди, розчином оцтової кислоти у випадку лугів.
Повторивши правила техніки безпеки, тепер можемо з вами зробить лабораторний дослід.
Проведемо лабораторний дослід взаємодія між кальцій оксидом і водою. В порцелянову чашку помістимо порошок СаО та обережно доллємо води. Відбувається бурхлива реакція з виділенням тепла. Утворюється пухкий білий порошок кальцій гідроксиду (гашеного вапна), що частково розчиняється у воді. Дослідимо добутий розчин лакмусовим папірцем – папірець забарвлюється в синій колір. Лакмусовий папірець є індикатором (від англійського indicate – вказувати), зміна його кольору свідчить про присутність кислоти чи лугу в розчині. Як кінцевий результат досліда ми з вами запишемо рівняння реакції.
Рівняння реакції СаО + Н2О = Са(ОН)2 (кальцій гідроксид або гашене вапно)
2. Поняття про кислоти.
Для начала діти ми з вами запишимо в зошит що таке кислоти?
Отже, кислоти – це складні речовини, які складаються з атомів Гідрогену, з’єднаними з кислотними залишками. Зараз ми з вами попрацюємо з підручником, відкриваємо і записуємо рівняння реакції.
Запишемо рівняння реакцій.(ст 161 підручника Табл. 5)
Оксид неметалу + вода = кислота
SO2 + H2O →
P2O5 + H2O →
Бачу діти ви трохи втомилися тому давайте проведемо фізкульт хвилинку!!!
Слухати ми перестали I тепер вci дружно встали. Будемо відпочивати, Нумо вправу починати. Руки вгору, руки вниз, I легесенько прогнись. Покрутились, повертілись, На хвилинку зупинились. Пострибали, пострибали, Раз — присіли, другий — встали. Хто ж там, хто вже так стомився? І наліво нахилився. Треба дружно всім нам встати, Фізкультпаузу почати. Руки вгору, руки вниз, Вгору трішки подивись. Руки склали, як вітряк, І покрутимося так. Вище руки підійміть І спокійно опустіть. Потім дружно всі сідаймо І до праці приступаймо.
3.Поняття про основи.
Отже, разом записуємо в зошит.
Основа – це складна речовина, яка утворена атомом металу та однією або кількома групами ОН. Розчинні у воді основи називаються лугами. Зараз ми з вами попрацюємо з підручником, відкриваємо і записуємо рівняння реакції.
Запишемо рівняння реакцій. (ст 161 підручника табл.6)
Оксид металу + вода = основа
Na2O + H2O →
CaO + H2O →
4. Поняття про індикатори.
Запишимо з підручника (ст.162) з вами у зошит визначення.
Індикатор (від англ. слова «визначати») — це складні органічні речовини, які змінюють свій колір у розчинах кислот і лугів.
Діти, розгляньте індикатори на ваших столах. Зверніть увагу на їх складні назви. Ми з вами разом визначимо колір індикаторів в дистильованій воді, середовище нейтральне. Вчитель демонструє колір індикаторів у нейтральному середовищі.
Для того, щоб ви могли провести досліди ми з вами вже повторювали правила техніки безпеки. Я думаю ви ще не забули їх!!!
Тому можете виконати дослід, заповніть таблицю, користуючись інструкцією:
- Налийте у три пробірки 1- 2мл розчинів сульфатної кислоти H2SO4
- Налийте у інші три пробірки розчину натрій гідроксиду NaOH.
- У кожну пробірку по черзі додати краплю індикатора: лакмусу, метил оранжевого, фенолфталеїну.
- Запишіть результат у таблицю.
|
Індикатор
|
Забарвлення досліджуваної речовини |
||
|
Дистильована вода (нейтральне середовище) |
Розчин кислоти(кисле середовище) |
Розчин лугу (лужне середовище) |
|
|
Лакмус |
|
|
|
|
Метилоранжевий |
|
|
|
|
Фенолфталеїн |
|
|
|
Відповідь:
|
Індикатор
|
Забарвлення досліджуваної речовини |
||
|
Дистильована вода (нейтральне середовище) |
Розчин кислоти(кисле середовище) |
Розчин лугу (лужне середовище) |
|
|
Лакмус |
Фіолетовий |
червоний |
Синій |
|
Метилоранжевий |
Оранжевий |
червоний |
Жовтий |
|
Фенолфталеїн |
Безбарвний |
не забарвлює |
Малиновий |
V. Закріплення вивченого матеріалу.
Діти, сьогодні ми з вами поглибили свої знання про взаємодію води з оксидами, поняття про кислоти, основи, та індикатори.Тому закріпимо урок виконанням тесту.
Тести
1. Формула сульфатної кислоти:
а) Н2SO3; б) Н2SO4; в) Н2S.
2. Масова частка речовини в розчині вимірюється у:
а) грамах; б) мілілітрах; в) %
3. Виберіть формулу гашеного вапна:
а) СаО; б) СаС12; в) Са(ОН)2.
4. Індикатором називають:
А) всі існуючі речовини
Б) лише органічні речовини
В) речовини, що змінюють своє забарвлення, залежно від середовища
Г)речовини червоного або малинового кольору.
5. Найпоширеніший оксид у природі:
а) СаО;б) Н2O; в) А12O3.
6. Укажіть луг:
а) Мg (ОН)2; б) NаОН; в) Fe(OН)3.
7. Оксид, що може перебувати в трьох агрегатних станах:
а) SO3; б) Cl2O7; в) Н2O.
8. Гідрат оксиду Р2О5 є:
а) кислотою; б) основою; в)оксидом
9. У кислому середовищі фенолфталеїн:
А)малиновий
Б)червоний
В)фіолетовий
Г)безбарвний
10. Укажіть позначення масової частки :
а) m ; б)V ; в) w.
11. До основ належить:
а) НС1; б) КОН; в) SO2.
12. У лужному середовищі жовтіє саме:
А)фенолфталеїн
Б)метиловий оранжевий
В)лакмус
Г)правильної відповіді немає
VI. Домашнє завдання.
Вивчити§ 24, опрацювать конспект, впр 2, 7 ст 164.
- Григорович О. В. Хімія: підруч. для 7 класу. загальноосвіт. навч. закл. / О. В. Григорович. - Х.: Вид-во «Ранок», 2015. - 192с.:іл.


про публікацію авторської розробки
Додати розробку
