Урок : Окисно-відновні реакції . Значення окисно-відновних реакцій у природі та техніці.
Урок з теми окисно-відновні реакції . Значення окисно-відновних реакцій у природі та техніці.
Мета якого розширити знання учнів про окисно-відновні реакції, показати значення окисно-відновних реакцій в житті людини і в природі; продовжити формувати навички складання найпростіших окисно-відновних рівнянь реакцій; закріпити вміння урівнювати окисно-відновні реакції методом електронного балансу.
Слайд №1: Формула успіху (створення позитивного настрою, налаштування на роботу) « Хочу,можу,зроблю!»
Слайд №2:
Тема: Окисно-відновні реакції . Значення окисно-відновних реакцій у природі та техніці.
Мета: розширити знання учнів про окисно-відновні реакції, показати значення окисно-відновних реакцій в житті людини і в природі; продовжити формувати навички складання найпростіших окисно-відновних рівнянь реакцій; закріпити вміння урівнювати окисно-відновні реакції методом електронного балансу.
Обладнання: періодична система хімічних лементів, таблиця розчинності, мультимедійна презентація до уроку, картки із завданнями.
Тип уроку: формування вмінь і навичок
Епіграф до уроку: «Шлях до розвитку й ,у решті решт, до щастя людини полягає через її працю».(Д.І.Менделєєв.)
Хід уроку
І. Актуалізація опорних знань та мотивація навчальної діяльності учнів.
а) Фронтальне опитування у формі «мікрофону»
Слайд №3
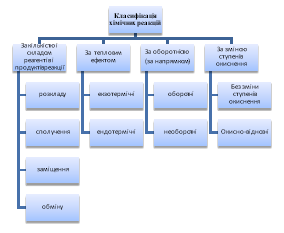
Кожен учень отримує питання від вчителя і дає відповідь :
- За якими ознаками класифікують хімічні реакції?
- Які реакції називаються реакціями сполучення?
- Які реакції називаються реакціями розкладу?
- Які реакції називаються реакціями заміщення?
- Які реакції називаються реакціями обміну?
- Що таке тепловий ефект реакції?
- Які реакції відносяться до екзотермічних?
- Які реакції відносяться до ендотермічних?
- Які реакції називаються оборотними?
Б)робота із мультимедійною дошкою
Слайд №4
Вкажіть, які реакції із даних є екзотермічними:
1) S + O2 =SO2 +293 кДж;
2) Fe2O3 + 3H2 = 2Fe + 3H2O ─ 89,6 кДж;
3) 2Н2 + О2 = 2Н2О; ∆Н = ─ 286 кДж;
4) С + Н2О = СО + Н2; ; ∆Н = +131,4 кДж.
Слайд №5
Установіть відповідність між рівняннями хімічних реакцій та їх типами.
1 K2O + H2O = 2KOH; А обміну;
2 3NaOH + H3PO4 = Na3PO4 + 3H2O; Б заміщення;
3 Fe(OH)2 = FeO + H2O; В сполучення;
4 2Na + 2H2O = 2NaOH + H2. Г розкладу;
Д полімеризації.
В) Інтерактивна вправа «Закодоване слово»
Відгадай закодоване слово (робота в парах)
Приклад:
|
Рівняння реакції |
Типи хімічних реакцій |
|||
|
Сполучення |
Розклад |
Заміщення |
Обмін |
|
|
Mg+2HCl→MgCl2 +H2 |
М |
Н |
Ш |
О |
|
2Ca + O2 →2CaO |
И |
Г |
Р |
С |
|
NaCl + AgNO3→NaNO3+AgCl |
Т |
У |
Ш |
Ф |
|
2Fe(OH)3→Fe2O3+3H2O |
А |
Р |
Б |
В |
|
H2 SO4 + BaCl2→BaSO4+2HCl |
Г |
Д |
Є |
О |
|
2H2 + O2 →2H2O |
В |
Д |
Ж |
Ч |
|
Na2 CO3+ 2HCl→2NaCl+H2 O+CO2 |
З |
І |
Л |
К |
|
2Hgo→2Hg + O2 |
Ю |
А |
Я |
Х |
Г)Вправа «Закінчити речення»
- Скільки типів хімічних реакцій виділяють за зміною ступенів окиснення? (2)
- Як називаються реакції, в яких ступінь окиснення атомів не змінюється? (реакції без зміни ступенів окиснення)
- Як називаються реакції, в яких ступінь окиснення атомів змінюється? (окисно-відновні)
- Атом, молекула або йон, які приєднують електрон? (окисник)
- Атом, молекула або йон, які віддають електрон? (відновник)
- Процес приєднання електронів називається… (відновлення)
- Процес віддавання електронів називається… (окиснення)
Слайд № 6
Перевірте правильність ваших відповідей
Слайд №7 Прогнозування окисно-відновних властивостей сполук.
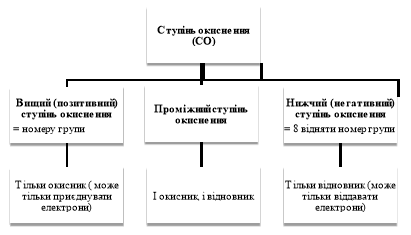
Фронтальна бесіда:
Пригадуємо схему, над якою ми працювали на минулому уроці. Скажіть будь ласка
- Чи може в реакції бути лише процес окиснення? (ні)
- Чи може в реакції бути лише процес відновлення? (ні)
- елемент з найнижчим ступенем окиснення може бути лише … (відновником)
- елемент з найвищим ступенем окиснення може бути лише … (окисником)
- Елемент з проміжним ступенем окиснення може бути лише …(і окисником, і відновником)
Слайд 8
Пояснити на прикладі елемента хлору його здатність проявляти ОВ властивості за даною схемою
Приклад
Ступені окисненя Cl -1, 0, +1, +3, +5, +7
![]()
![]()
![]()
лише і окисник, і лише окисник
відновник відновник (найвищий СО)
(найнижчий СО)
*** Домашнім завданням було з*сувати , який у природі найпоширеніший окисник,а який найпоширеніший відновник, а також які окисники та відновники використовують в лабораторних умовах.
Повідомлення учнів
1-й учень. Найпоширеніший на землі окисник – кисень. Набагато сильніший – озон – алотропна модифікація Оксисену . Він має здатність окислювати багато речовин, які з киснем за звичайних умов не реагують, наприклад нітроген(IV)оксид.
Сильний окисник серед простих речовин – фтор. Але він надзвичайно активний і його важко добути у вільному стані. В лабораторних умовах використовують такі (прикріпити до дошки картки ) окисники:
KMnO4 – калій перманганат,
K2Cr2O7 - калій дихромат,
HNO3 – нітратна кислота,
H2O2 – гідроген пероксид,
Cl2 – хлор.
Надзвичайно активні окисники – Флориди ксенону.
2-й учень . Із відновників найпоширеніший у природі вуглець. Його широко використовують у промисловості для добування металів і оксидів.
Другу позицію займає водень. Під час нагрівання він легко забирає атоми Оксисену в багатьох оксидів, утворюючи воду.
Дуже активними відновниками є лужні, лужноземельні елементи, алюміній.
У лабораторних умовах відновниками є сполуки, які містять елементи в низьких ступенях окиснення:
відновники
H2S – сірководень,
HI – йодидна кислота,
SnCl2 - станум(II) хлорид.
Д) Інтерактивна вправа «Сніжний ком» (визначення ступенів окиснення)
І ряд
«СНІЖНИЙ КОМ»
Визначити ступінь окиснення Нітрогену в сполуках:
N2, N2O, NO, N2O3, N2O5, NH3, HNO3.
Максимальний ступінь окиснення Нітрогену в сполуках:
Мінімальний ступінь окиснення Нітрогену в сполуках:
______________________________________________
ІІ ряд
«СНІЖНИЙ КОМ»
Визначити ступінь окиснення Сульфуру в сполуках:
S, H2S, SO2 ,SO3 ,H2SO4 ,Na2S, K2SO3.
Максимальний ступінь окиснення Сульфуру в сполуках:
Мінімальний ступінь окиснення Сульфуру в сполуках:
____________________________________________
ІІІ ряд
«СНІЖНИЙ КОМ»
Визначити ступінь окиснення Хлору в сполуках:
Cl2 ,Cl2O7, HCl ,HClO, HClO4, KCl, HClO3,
Максимальний ступінь окиснення Хлору в сполуках:
Мінімальний ступінь окиснення Хлору в сполуках:
Слайд №9
Завдання:Які процеси відображають схеми.(Робота в парах,3 хвилини,
Учні зачитують схеми, аналізують процеси переходу(зміщення) електронів від одних атомів до інших.
Вчитель:
Чим пояснити зміну ступенів окиснення елементів в окисно-відновних реакціях?
Учень: Зміна ступеня окиснення відбувається за рахунок переходу(чи зміщення)електронів від одних атомів (молекул, йонів) до інших.
Слайд №10
Установіть відповідність між схемою перетворення та кількістю електронів, відданих або приєднаних атомами, вкажіть окисник і відновник, процеси окиснення та відновлення.
|
А |
|
|
Б |
|
|
В |
|
|
Г |
|
|
Д |
|
А) Р0 → Р─3 ;
Б) S┼6 → S─2 ;
В) Fe┼2 → Fe┼ 3; 1.+ 8е─
Г) Cl20 → 2Cl─; 2. + 3е─
3. + 2е─
4. ─1е─
Слайд №11
Доведіть,що реакція ОВ. Назвіть процеси та їх учасників
![]()
Слайд №12
 Перевірте правильність ваших відповідей
Перевірте правильність ваших відповідей
Вчитель: Що ми знаємо про метод електронного балансу?
Пригадаємо алгоритм складання ОВР з допомогою методу електронного балансу.
Слайд 13
Алгоритм складання окисно – відновних реакцій
1.Розставляємо ступені окиснення елементів.
2.Визначаємо елементи, що змінили ступені окиснення.
3. Виписуємо ці елементи.
4.Визначаємо зміну кількості електронів за ступенем окиснення елементів.
5.Складаємо електронний баланс.
6.Проставляємо коефіцієнти в рівнянні реакції.
7. Визначаємо окисник і відновник, процеси окиснення та відновлення
Вчитель демонструє відеодослід «Взаємодія ртуті з концентрованою нітратною кислотою»
Робота біля дошки :розставити коефіцієнти методом електронного балансу у рівнянні реакції, яке переглянули під час відео досліду
***Учні зачитують приклади текстів виконаних вдома(домашнє творче завдання було скласти міні- твір або знайти в інтернеті про найсильніші окисники та відновники)
1.«Флуор – найсильніший окисник».
У Флуора , як і у всіх галогенів була своя заповітна мрія. Лише одного електрона не вистачало йому для нового щастя, щоб стати таким спокійним та горділивим як Неон. І вирішив він вкрасти електрон. Довго ходив таблицею, приглядався, в кого ж можна поцупити електрон. Оксиген, спостерігаючи за ним, трішки побоювався і швиденько подружився з двома Гідрогенами, утворивши Воду. «Ось тепер я переможу Флуор» - подумав зв’язаний з Гідрогеном Оксиген.
Вода вирішила побороти Флуор! Та де там! Флуор виявився сильнішим. Вода, якою гасили пожежу, сама загорілася у Флуорі. Оксиген, який вважався окисником, у цій реакції перетворився на відновника. Так Флуор продемонстрував, що він найсильніший окисник.
2.«Гідроген – хороший відновник »
Якось зібралися метали-відновники і стали вести розмову про те, хто кого відновив, хто є найкращим. Гомоніли між собою лужні метали: « Ми ж найшвидше віддаємо електрони, ми робимо добру справу, ми найкращі». З’явився навіть Карбон(II)оксид –чадний газ: «Хоча я дуже отруйний, але як відновником мною дуже пишаються».
Все це чув завжди маленький сором’язливий Гідроген і дуже засмутився: «Чому вони? А не я? Мабуть тому, що у мене один єдиний електрон і один протон?» І Гідроген заплакав. Це почули інші елементи і почали розпитувати, втішати: «Ні, ти хороший відновник» - наперебій говорили метали - «Ти позбавив нас Оксигенового рабства». Прийшли навіть деякі органічні речовини втішати Гідроген та дякувати за відновлення.
Так друзі допомогли повірити Гідрогену, що він хороший відновник.
3.«Оксиген - сильний окисник»
Жив собі Оксиген. Був він гордовитий, зухвалий і такий сильній, що з ким не зустрічався, відразу вимагав віддати йому 2 електрона, всіх він окиснював. Запишався Оксиген: «Я найсильніший, найспритніший, кращого за мене немає!» І назвали його Окисником, а речовини, з якими він взаємодіяв – оксидами. Зазнався зовсім Оксиген, ходить собі по таблиці зі всіма знайомиться, всі йому друзі, але не на рівних, тому що він у них відбирає електрони. Одного Флуора він дуже боявся. А от Аурум та Платина з ним знатися не хотіли, повністтю його ігнорували.
ІІІ. Поглиблення теми сприйняття нового матеріалу
Робота з підручником П.21 стор .130 (Григорович О.В.)
Вчитель: прочитайте і скажіть,які виокремлюють види реакцій серед реакцій, які відбуваються із зміною ступенів окиснення ?
1.Міжмолекулярні
2.Внутрішньомолекулярні
3.Кислотно – основні:нейтралізації
(Обговорення з учнями)
Вчитель:Навколо нас в природі відбувається велика кількість хімічних реакцій: виверження вулкану, фотосинтез, дихання, травлення… Ми, люди, також широко використовуємо хімічні процеси. Наприклад, горіння сірника, добування металів із руд, приготування їжі та інше. Серед цих хімічних процесів велика кількість належить до окисно-відновних реакцій.
Окисно-відновні реакції надзвичайно поширені і важливі. Де саме вони зустрічаються, яка їх роль в природі і житті людини ми з’ясуємо на сьогоднішньому уроці.
Завдання для учнів:переглянути презентацію та прочитати текст із додаткового підручника Попель П.П. на с.76, назвати позитивне та негативне значення ОВР.
Презентації учнів (випереджаюче завдання)
(під час презентації до дошки прикріплюються приклади схем ОВР що відбуваються у природі,побуті)
Приблизний текст виступів учнів (слайди):
2-3
На планеті Земля постійно відбуваються хімічні перетворення. Нами були проведені дослідження:ОВ в природі,біосистемах,металургії,хім..промисловості та в побуті.
4
Окисно-відновні процеси належать до числа найбільш розповсюджених хімічних реакцій і мають величезне значення в теорії і практиці. Окисно-відновні процеси - одні з найважливіших процесів природи, їх ще називають окисно-відновними реакціями (ОВР).
5
ОВ процеси в природі.
Засвоєння вуглекислого газу рослинами з виділенням кисню. Фотосинтез — це процес трансформації поглинутої організмом енергії світла в хімічну Е органічних і неорганічних сполук.
6
Виверження вулкану. Цей природний катаклізм супроводжується низкою окисно-відновних реакцій.(Прикріплюємо до дошки схеми реакцій)
7 Грозові розряди – захоплююче явище природи. Під час грози відбувається зв'язування атмосферного азоту. Це теж ОВР. .(Прикріплюємо до дошки схеми реакцій)
8
ОВР в живих системах. Травлення.
Життя організму неможливе без поповнення його тканин енергією, будівельним матеріалом, вітамінами, мінеральними речовинами і водою. Воно здійснюється за рахунок їжі. Щоб з харчових продуктів вивільнилась енергія і вони стали придатними для включення в обмін речовин. Їжа в травному апараті піддається механічній і хімічній обробці, ця обробка відбувається під впливом ферментів до складових частин, які придатні до всмоктування в кишківнику і подальшого засвоєння в тканинах. Отже, процес розщеплення складних органічних речовин на прості розчинні сполуки, які можуть всмоктуватися і засвоюватися організмом, називається травленням.
9
Дихання – це сукупність процесів, в результаті яких відбувається вживання організмом кисню, його використання і виведення вуглекислого газу.
10
Обмін речовин і енергії, або метаболізм, - сукупність хімічних і фізичних перетворень речовин і енергії, які відбуваються в живому організмі і забезпечують його життєдіяльність. Енергія, яка звільняється в процесі метаболізму необхідна для здійснення роботи, росту, розвитку і забезпечення структури і функцій всіх клітинних елементів. Обмін речовин і енергії складає єдине ціле.
11
ОВР в побуті. Нажаль, продукти харчування мають властивість через деякий час псуватися. Це також окисно-відновна реакція.
12
Горіння звичайного сірника – це теж ОВ реакція. .(Прикріплюємо до дошки схеми реакцій)
13
Пожежа - неконтрольований процес горіння, що заподіює матеріальну шкоду, шкоду життю і здоров'ю людей, інтересам суспільства і держави.
14
Вибух — надзвичайно швидке перетворення речовини, яке супроводжується миттєвим виділенням великої енергії в невеликому об'ємі. Суттєвою ознакою вибуху є різке збільшення тиску, яке викликає у навколишньому середовищі ударну хвилю.
15
Фейерве́рк— декоративні вогні різноманітних кольорів і форм, які одержують при спалюванні піротехнічних сумішей задля розваги. Піротехнічні суміші містять речовини-окисники.
16
Корозія металів - руйнування металів внаслідок фізико-хімічного впливу зовнішнього середовища, при якому метал переходить в окиснений стан і втрачає властиві йому властивості.
17
Окиснення металів – реакція з'єднання металу з киснем, що супроводжується утворенням оксидів. У ширшому сенсі це — реакції, в яких атоми втрачають електрони і утворюються різні з'єднання, наприклад хлориди, сульфіди і т.п. У природі метали знаходяться майже виключно в окисленому стані.
19-18
Спалювання пального в двигунах внутрішнього згоряння – це ОВР, під час якої вивільнюється велика кількість енергії. Варто пам’ятати про забруднення навколишнього середовища, про смог, що утворюється на вулицях міст з великою кількістю автотранспорту.
21-20
Горіння за сучасними уявленнями — складний фізико-хімічний процес на основі екзотермічних реакцій окиснення-відновлення, який характеризується значною швидкістю перебігу, виділенням великої кількості тепла і світла, масообміном з навколишнім середовищем. При горінні, як правило, утворюється полум'я. Горіння може початися спонтанно внаслідок самозаймання або бути ініційованим запалюванням.
22
ОВР в металургії. Найважливіший спосіб одержання металів із руд ґрунтується на відновленні оксидів відповідних металічних елементів вугіллям (коксом).
Також оксидні руди відновлюють карбон(ІІ) оксидом, інколи – воднем. Менш активні металічні елементи можна відновлювати активнішими металами і деякими неметалами. Відновлення магнієм називають магнієтермією, відновлення алюмінієм – алюмінотермією, силіцієм – силікотермією.
24-23
Синтез хімічний – цілеспрямоване здобуття складних речовин з простіших, що грунтується на знанні молекулярної будови і реакційної здатності останніх. Зазвичай під синтезом мається на увазі послідовність декількох хімічних процесів (стадій). Добування із складних речовин простих – це також ОВР. Це виробництво мінеральних добрив, синтетичних мийних засобів,ліків,фарб,полімерних матеріалів, засобів захисту рослин, тощо…
Висновок.
Окисно-відновні реакції належать до найбільш поширених.
В живій природі енергія, яка виділяється під час ОВР, забезпечує життєдіяльність організмів.
ОВР лежать в основі процесів металургії, технічного виробництва амоніаку, нітратної та сульфатної кислот, горіння паливних матеріалів, хімічних джерел електричного струму.
Іноді ОВР відіграють негативну роль
Вчитель:
- Отже, ОВР дуже поширені і мають велике значення (слайд 31).
Які з перелічених ОВР мають позитивне значення?
Які з перелічених ОВР мають негативне значення?
Обговорення відповідей учнів)
ІV. Рефлексія
- Що нового дізнались на уроці?
- Чи все було зрозуміло?
- Що виявилося складним і потребує додаткового вивчення?
- Чи сподобався урок?
V. Узагальнення матеріалу. Підсумок уроку.
VІ. Домашнє завдання (рівневі):
§21, стор.130 (Григорович О.В.) та сильнішим учням додатково виконати
*** Розставити коефіцієнти методом електронного балансу:
N2 + O2 -> NO
NO + O2 -> NO2
KClO3 -> O2 + КСІ
Р + О2 -> Р2О5
Р + КСІО3 -> Р2О5 + + КСІ
S + KClO3 -> SO2 + + КСІ
H2S + O2 -> SO2 + H2O
Н2S + SO2 -> H2SO4 + S
*** Повідомлення «Природні каталізатори»
1

про публікацію авторської розробки
Додати розробку
