Урок "Особливості будови атома Карбону в основному та збудженому станах. Метан. Молекулярна, електронна і структурна формули метану, поширення в природі"
Цей урок допоможе розширити знання учнів про хімічний склад вуглеводнів та їх класифікацію; формувати знання учнів про молекулярну, електронну й структурну формули метану; поглибити знання про фізичні властивості метану й поширеність його в природі.
Тема. Особливості будови атома Карбону в основному та збудженому станах. Метан. Молекулярна, електронна і структурна формули метану, поширення в природі
Мета уроку.
Навчальна. Розширити знання учнів про хімічний склад вуглеводнів та їх класифікацію; формувати знання учнів про молекулярну, електронну й структурну формули метану; поглибити знання про фізичні властивості метану й поширеність його в природі.
Розвивальна. Розвивати в учнів інтерес до вивчення хімії, логічне мислення, вміння планувати свою діяльність, аналізувати і робити висновки.
Виховна. Виховувати повагу до думки інших, вміння висловлюватися, акуратність, спостережливість, самостійність.
Тип уроку: вивчення нового матеріалу.
Хід уроку
I. Організація класу
II. Перевірка домашнього завдання.
Фронтальна робота за питаннями
- Чому органічну хімію називають хімією сполук Карбону?
- Складіть схему будови атома Карбону. (1 учень біля дошки)
- Назвіть можливі валентності та ступені окиснення атома Карбону.
- Чому атоми Карбону можуть утворювати хімічні зв'язки один з одним?
ІІІ. Актуалізація опорних знань
Вуглеводні
Термін «вуглеводні» походить від старих назв елементів: Карбон — «вуглець», а Гідроген — «водень». Отже, це сполуки Карбону з Гідрогеном.
Метан — найпростіший вуглеводень, молекула якого складається з одного атома Карбону і чотирьох атомів Гідрогену.
Вуглеводні поділяють на насичені та ненасичені.

IV. Вивчення нового матеріалу
Метан. Молекулярна і структурна формули метану
Метан СН4 — найпростіший насичений вуглеводень. Напишемо електронну формулу Карбону та її графічний варіант. Зауважмо, що в органічній хімії замість вислову «графічна формула» вживають термін «структурна формула».
В основному стані на зовнішньому енергетичному рівні атома Карбону розміщуються 4 електрони: два на s-орбіталі та два на р-орбіталі. Однак одна р-орбіталь залишається вакантною. Унаслідок збудження атома один електрон з s-орбіталі переходить на вакантну р-орбіталь:
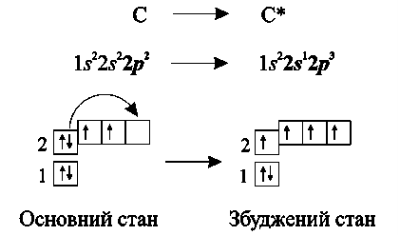
Під час утворення молекули метану СН4 атом Карбону перебуваючи у збудженому стані, використовує чотири неспарених електрони на утворення спільних ковалентних пар з чотирма атомами Гідрогену.
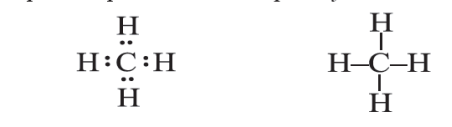
Рис. 24.1. Електронна та структурна формули метану
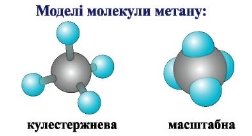
Пригадаймо, що в кулестержневій моделі кожен стержень — це одинарний зв’язок між атомами. Масштабна модель показує відношення розмірів атомів у молекулі. Якщо центри атомів у молекулі метану сполучити відрізками, то утвориться правильний чотиригранник — тетраедр. Тому кажуть, що молекула метану має форму тетраедра. У його центрі розміщується атом Карбону, а на чотирьох вершинах — атоми Гідрогену.
Поширеність у природі та фізичні властивості метану
У природі Землі метан доволі поширений. Він утворюється в процесі анаеробного розкладання органічних речовин, зокрема целюлози. Горючі природні гази зазвичай містять до 95 % метану. На дні боліт і ставків метан утворюється внаслідок розкладу решток рослин без доступу повітря. Тому його ще називають болотним газом. Також метан нагромаджується у вугільних, соляних шахтах унаслідок виділення із пластів вугілля і супутніх порід, де він міститься у вільному та зв’язаному стані. У цьому разі його називають рудниковим газом.
Метан — безбарвний газ без запаху й смаку, майже удвічі легший за повітря. У воді малорозчинний. На повітрі або в атмосфері кисню він горить неяскравим полум’ям. Його суміш з повітрям вибухонебезпечна. Метан за температури –162 ºС стає рідким, а за температури –182 ºС твердне.
Хімічні властивості метану
Заміщуючи в молекулах вуглеводнів один або кілька атомів Гідрогену на атоми інших елементів чи на цілі групи атомів (реакції заміщення), отримують похідні вуглеводнів.
Реакція метану з хлором (реакція хлорування) відбувається при освітленні:

Взаємодія метану з хлором відбувається в кілька етапів. За умов достатньої кількості хлору відбувається послідовне заміщення атомів Гідрогену на атоми Хлору: CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
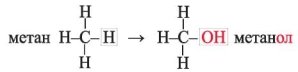
Якщо атом Гідрогену замістити на групу атомів –ОН, отримаємо метанол (метиловий спирт):
V. Первинне застосування одержаних знань
Контрольні запитання
- Скільки ковалентних зв’язків є в молекулі метану?
- Яка просторова будова молекули метану?
- Де метан трапляється в природі?
- Опишіть фізичні властивості метану.
- Чому органічну хімію можна назвати «хімією вуглеводнів та їх похідних»?
- Напишіть молекулярну, електронну та структурну формули метану.
- Чим відрізняються насичені та ненасичені вуглеводні? До якої їх групи належить метан?
Вправи та задачі
1. Обчисліть відносну густину метану за воднем.
|
Дано: СН4 |
Розв’язання
M(CН4)=16 г/моль M(Н2)=2 г/моль
Відповідь: 8. |
|
DН2(CН4) - ? |
2. Обчисліть масу 0,75 моль метану.
|
Дано: n(СН4) = 3 моль |
Розв’язання
M(СН4)=16 г/моль.
Тоді: Відповідь: 48 г. |
|
m(CН4) - ? |
3. Обчисліть об’єм 30 г метану (н. у).
|
Дано: m(СН4) = 30 г |
Розв’язання Обчислюємо кількість речовини СН4 за формулою:
Обчислюємо об’єм СН4 за формулою:
V(СН4)=1,875 моль·22,4 л/моль=42 л. Відповідь: 42 л. |
|
V(СН4) - ? |
7. Обчисліть масу суміші, яка містить 33,6 л метану і 44,8 л азоту.
|
Дано: V(СН4) = 33,6 л V(N2) = 44,8 л |
Розв’язання Обчислюємо кількість речовини СН4 за формулою:
Обчислюємо масу метану за формулою:
Обчислюємо масу азоту за формулою:
m(сум.)=24+32=56 г. Відповідь: 56 г. |
|
m(сум.) - ? |
10. Обчисліть масову частку Гідрогену в метані.
VI. Підсумки
- Вуглеводні — це сполуки Карбону з Гідрогеном.
- Вуглеводні бувають насичені й ненасичені. Критерієм поділу слугує типу хімічного зв’язку між атомами Карбону.
- Метан — найпростіший насичений вуглеводень.
VII. Домашнє завдання
Опрацювати § 24 ст. 121-122.
Виконати № 8, 9, 11 ст. 125.

про публікацію авторської розробки
Додати розробку
