Урок "Природа хімічного зв'язку. Електронегативність. Утворення йонів"
- Карта уроку.docx docx
- Технологічна карта уроку у 8 класі.docx docx
- Урок 8кл.pptx pptx
Тема уроку «Природа хімічного зв’язку. Електронегативність.
Перетворення атомів на йони»
- Мої здобутки
|
|
|
|
|
|
|
|
|
|
|
|
|
- З чого складається речовина? Відтворити схематично послідовність термінів.
- Зобразити електронну формулу атома F та Na.
- Атоми зв’язуються один з одним, тому що між ними існує__________________.
- Хімічний зв'язок може утворюватися двома способами: 1) _________________
______________________, 2) _____________________________________________.
- Утворення хімічного зв’язку у молекулі водню.
- Робота з інформаційною карткою.
Висновок: Правило октета Льюїса: ____________________________________________
________________________________________________________________________________________________________________________________________________________
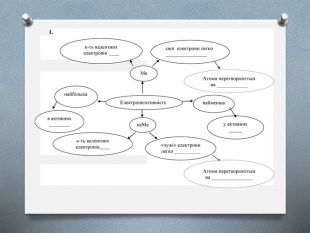
- Електронегативність – це здатність атома ______________ валентні електрони інших атомів. Найбільш електронегативний елемент - _____, найменш електронегативний - ______.
- Заповнити пропуски у схемі.


![]()
![]()
![]()
![]()

![]()
![]()

![]()

![]()
![]()
![]()

![]()
![]()

![]()
![]()
![]()



![]()
- Схема утворення йонів.
- Заповнити таблицю. Порівняти склад атома і відповідного йона.
|
Формула частинки |
Кількість протонів |
Кількість нейтронів |
Загальна кількість електронів |
Кількість електронів на зовн. рівні |
Електронна формула |
|
К |
|
|
|
|
|
|
К+ |
|
|
|
|
|
|
О |
|
|
|
|
|
|
О2- |
|
|
|
|
|
- Д/з. № § - це кількість електронів атома Алюміню, впр. № - це кількість протонів у ядрі Астату, кількість електронів у ядрі Францію, заряд ядра Радію.
Д/з § _____, впр. № _____, _____, _____.
Таблицю, якщо не встигли.
Інформаційна довідка.
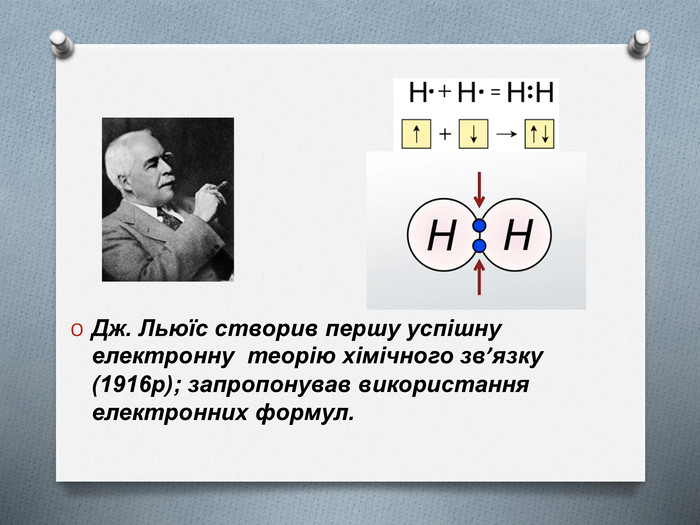
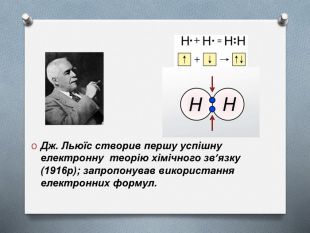
Не всі атоми можуть взаємодіяти між собою. Буває так, що при зближенні атомів і перекриванні їхніх електронних орбіталей молекула не утворюється. Наприклад, якщо два атоми Гелію наближаються один до одного, то загальна енергія увесь час збільшується, і молекула утворитися не може. Чому атоми в молекулі водню тримаються разом, а Гелій таку молекулу не утворює? На це питання дав відповідь американський вчений Джилберт Льюїс, який створив електронну теорію хімічного зв’язку (1916р); запропонував використання електронних формул.
Ця теорія заснована на уявленні про те, що електронні оболонки атомів інертних газів відрізняються особливою стійкістю, чим і пояснюється їхня хімічна інертність. Атоми всіх інших елементів при утворенні хімічного зв'язку прагнуть змінити електронну оболонку до конфігурації найближчого інертного газу, віддаючи або приєднуючи електрони. Тільки в цьому випадку утворюються стійкі молекули.
Технологічна карта уроку у 8 класі
на тему «Природа хімічного зв’язку. Електронегативність. Перетворення атомів на йони»
Цілі уроку: ознайомити учнів з поняттям «хімічний зв’язок» та причинами виникнення хімічного зв'язку між атомами в процесі утворення простих і складних речовин, типами хімічного зв'язку; розкрити зміст поняття електронегативність та його застосування для визначення типу хімічного зв'язку, пояснити процес перетворення атомів на йони; навчитися хімічно грамотно записувати процес утворення йонів; розвивати вміння працювати з великим об’ємом інформації за короткий час, формувати навички роботи в парах, робити висновки та прогнозування; виховувати повагу один до одного, вміння співпрацювати.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва, таблиця електронегативностей хімічних елементів, роздатковий матеріал, мульмедійна дошка.
Базові поняття та терміни: хімічний зв'язок, електрони, атоми, ядра атомів, неспарені електрони.
Форма проведення: урок з елементами бріколажу.
Тип уроку: вивчення нового матеріалу.
Хід уроку
І. Організаційний момент.
Привітання. Знайомство з учнями. Розказати про оцінювання зірочками.
Пропоную вашій увазі переглянути фото (3 слайди).
Які асоціації викликають у вас ці фото? Діти висловлюють припущення про зв'язок матері і дитини, про дружбу (де тримаються за руку), про зв'язок.
Так, ви праві. Ці фото уособлюють зв'язок між рідними людьми, між друзями, між зв’язаними частинами. А чи важко розірвати зв'язок між мамою та дитиною? (Практично не можливо).А між друзями? (важко, але можливо). А розв’язати вузлик) (досить легко). От і ми сьогодні із вами розглянемо зв'язок, але не звичайний особливий – хімічний зв'язок. Ми дізнаємося, між якими частинками виникає цей зв'язок, чи всі частинки вміють і хочуть дружити, якими способами виникає ця дружба, а чи є такі, що ні з ким не дружать і живуть самі по собі?
(Слайд 4) Отже, тема нашого уроку «Хімічний зв'язок, його природа. Електронегативність. Перетворення атомів на йони».
( Слайд 5) Цілі, які я сьогодні ставлю перед нами: зрозуміти, що таке хімічний зв'язок, пояснити, яка природа хімічного зв’язку, дати визначення поняття «електронегативність», вміти визначати електронегативність в різних елементах та порівнювати її в різних елементах, пояснити, як виникають йони та навчитися хімічно грамотно записувати процес утворення йонів; навчитися розрізняти катіони та аніони.
Пропоную наш урок провести у формі уроку з елементами бріколажу. Бріколаж – це форма організації навчання будь-якими засобами, предметами, окрім тих, що створені спеціально для навчання. Тобто пропоную вам сьогодні здобувати знання без використання звичних підручника та зошита. Єдине, без чого ми не можемо обійтись – це без королеви хімії – таблиці ПСХЕ.
II. Актуалізація опорних знань
Пригадайте, з чого складається речовина? ( на дошці хаотично слова, учні складають їх у схему): речовина, молекула, атом, ядро, протони, електрони, нейтрони.
Що таке атом?
3 яких частинок складається атом?
Який заряд має електрон?
Які електрони називають неспареними (валентними)?
Яка максимальна кількість електронів може міститься на зовнішньому енергетичному рівні?
ІІІ. Засвоєння нового матеріалу. Розповідь з елементами бесіди.
Природа хімічного зв’язку (слайд 6)
Понад 100 хімічних елементів утворюють понад 50 мільйонів відомих на даний час речовин, що складають наш фізичний світ. Чому? (діти відповідають)
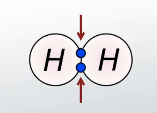
Отже, існує причина, за якою атоми зв’язуються один з одним. Цією причиною є хімічний зв’язок, який зумовлений тим, що між атомами діють певні електростатичні сили, здатні утримувати атоми один біля одного. Доведено, що в утворенні хімічного зв’язку між атомами головна роль належить валентним електронам (електронам зовнішнього рівня, які найслабше зв’язані з ядром). Таким чином хімічні зв’язки утворюються завдяки усуспільнення електронів (їх зсуву до ядра одного з атомів) або перенесенням електронів (їх відриванням чи приєднанням). Наприклад, (демонстрація кольорові схеми) найпростіший атом — атом Гідрогену містить всього один електрон, що перебуває на першому енергетичному рівні. При зближенні двох атомів Гідрогену ядро одного з них притягує електрони іншого атома і навпаки. Між атомами виникає взаємодія, і відстань між ними зменшується доти, поки взаємне притягання не врівноважиться відштовхуванням ядер. Але чи всі атоми сполучаються за таким принципом?
(робота з інформаційною карткою, діти опрацьовують текст)
Але, не всі атоми можуть взаємодіяти між собою. Буває так, що при зближенні атомів і перекриванні їхніх електронних орбіталей молекула не утворюється. Наприклад, якщо два атоми Гелію наближаються один до одного, то загальна енергія увесь час збільшується, і молекула утворитися не може.
Чому атоми в молекулі водню тримаються разом, а Гелій таку молекулу не утворює?
(слайд 7) Джилберт Льюїс (америк. вчений) створив першу успішну електронну теорію хімічного зв’язку (1916р); запропонував використання електронних формул.
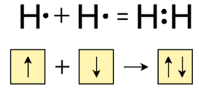
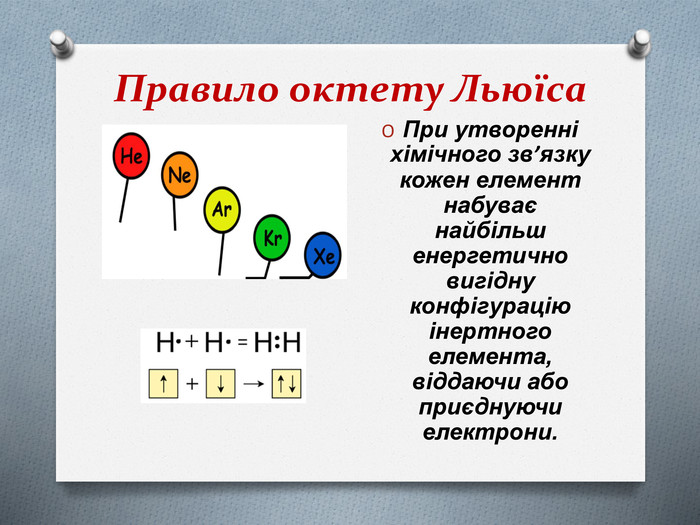
Ця теорія заснована на уявленні про те, що електронні оболонки атомів інертних газів відрізняються особливою стійкістю, чим і пояснюється їхня хімічна інертність. Атоми всіх інших елементів при утворенні хімічного зв'язку прагнуть змінити електронну оболонку до конфігурації найближчого інертного газу, віддаючи або приєднуючи електрони. Тільки в цьому випадку утворюються стійкі молекули. Це твердження зараз називають правилом октету Льюіса (від латинського слова «окто» — вісім), тому що атоми всіх інертних газів, крім Гелію (який містить 2 електрони), містять на зовнішньому рівні вісім електронів.
(слайд 8) Правило октету: при утворенні хімічного зв’язку кожен елемент набуває найбільш енергетично вигідну конфігурацію інертного елементу s2p6 віддаючи чи набуваючи електрони. (ЗАПИСАТИ В КАРТКУ)
Тепер зрозуміло, чому молекула Н2 стійка, а молекула Не не існує. Це пов'язане з тим, що атому Гідрогену до завершення зовнішнього рівня не вистачає одного електрона. При утворенні молекули Н2 електрони двох атомів поєднуються і електронна конфігурація кожного атома доповнюється до конфігурації атома Гелію. У той же час в атомі Гелію зовнішній енергетичний рівень вже заповнений, цим атомам просто не потрібні «чужі» електрони.
Завдання для закріплення.
1)Користуючись таблицею Менделєєва, визначити скільки електронів не вистачає до октету атомам Нітрогену, Хлору, Сульфуру, Карбону, Флуору, Оксигену? (відповіді дітей з поясненням)
2) До електронної конфігурації яких інертних елементів прагнуть атоми Літію, Оксигену, Кальцію, Алюмінію, Хлору?
3) Давайте пригадаємо, як поділяються усі елементи за характером простих сполук, які вони утворюють? (неметали та метали)
Де розташовані у періодичній системі типові металічні елементи? А де типові неметалічні елементи? На що вказує номер групи, в якій розташований елемент? (на кількість електронів на зовнішньому рівні)
Давайте спрогнозуємо, кому легше буде віддавати електрони?( ). А кому вигідніше притягувати електрони? ( )
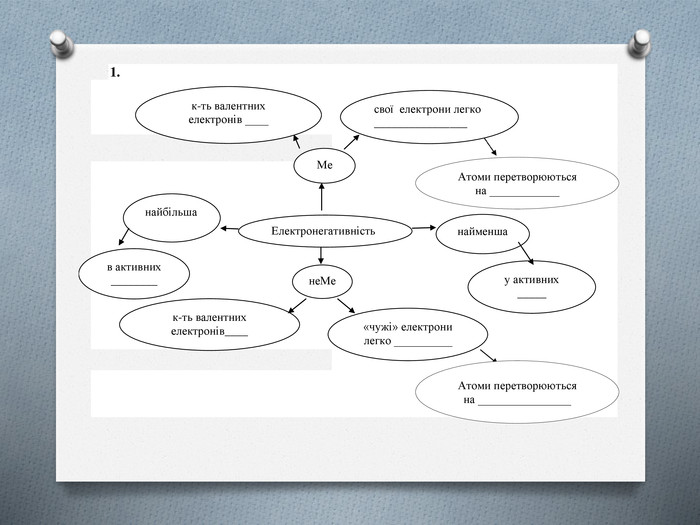
(слайд 9) Здатність атома притягувати валентні електрони інших атомів називають електронегативністю. Поняття електронегативності ввів в хімію Лайнус Полінг (амер.вчений, нобелівський лауреат за вивчення природи хімічного зв’язку). Електронегативність чисельно обрахована і подана в окремих таблицях або у Таблиці періодичної системи хімічних елементів. Сильніше всього притягують електрони атоми найбільш активних неметалічних елементів: Флуору, Оксигену, Хлору, адже їм для завершення зовнішнього рівня не дістає одного або двох електронів. І електрони, що вони прийматимуть, розташуються досить близько до ядра — на другий або третій електронний шар. Тому електронегативність цих елементів найбільша. Легше всього віддають електрони атоми активних металічних елементів, у першу чергу лужних: Літію, Натрію, Калію тощо. Вони виявляють найменшу електронегативність.
(слайд 10) Оскільки електронегативність — це властивість, що також пов'язана з прийомом-втратою електронів, то і змінюватися в Періодичній системі вона буде так само, як і металічні властивості: в періодах електронегативність збільшується зліва направо з посиленням неметалічних властивостей, а в групах зменшується згори до низу. Отже елемент з найбільшою електронегативністю — Флуор, а з найменшою — Францій.
А яку іще періодичну зміну можна прослідкувати в атомах в межах ПСХЕ? (зміну металічних та неметалічних властивостей)
Висновок
1) В періодах зліва направо в міру зростання заряду ядер атомів зменшується радіус атома – електронегативність зростає.
2) У головних підгрупах зверху вниз в міру зростання радіусів атомів – електронегативність зменшується.
(слайд 11) Отже, підсумовуючи знання про електронегативність, заповнимо схему


![]()
![]()
![]()

![]()
![]()
![]()

![]()

![]()
![]()
![]()
![]()
![]()


![]()
![]()
![]()


![]()

У світі існує багато сполук, які складаються із атомів Ме, неМе, Ме+неМе, неМе+неМе. Які зв’язки між ними виникають?
Утворення стійкої електронної конфігурації може відбуватися кількома способами та призводить до утворення молекулярних або немолекулярних сполук різної будови. Внаслідок цього розрізняють ковалентний та іонний типи хімічного зв’язку. Крім цих, існують й інші типи хімічного зв’язку: металічний та водневий (міжмолекулярний).
Сьогодні детальніше розглянемо як утворюються йони.
Пояснення утворення катіонів та аніонів дозаповнюємо схему зі слайду 11)
(слайд 12) Завдання. Вчитель називає атом, а учні піднімають рожеве, жовте, синє чи зелене яблуко. Якщо атом віддає 1 електрон – рожеве, якщо 2 – жовте, якщо приєднує 1 електрон – синє, якщо 2 приєднує – зелене.
Літій, Сульфур, Бром, Селен, Рубідій, Магній, Флуор, Оксиген, Натрій, Хлор, Кальцій, Магній, Йод.
ІV. Первинна рефлексія
Гра «True or false» «Вірю-не вірю» Права рука – true, ліва - false.
- Під час утворення хімічного зв’язку атоми прагнуть до створення зовнішнього енергетичного рівня з 8 електронів ( true )
- В утворенні хімічного зв’язку беруть участь протони ( false )
3. Головна роль в утворенні хімічного зв’язку належить валентним електронам (true)
4. Хімічний зв'язок – це взаємодія атомів, що зумовлює стійкість багатоатомних частинок (true)
5. Атом, який “позбувся” електронів перетворюється на аніон (false )
6. Атом, який приєднав електрони перетворюється на аніон (true)
Завдання. Cамостійна робота з таблицею.
Заповнити таблицю. Порівняйте склад атома і відповідного йона.
|
Формула частинки |
Кількість протонів |
Кількість нейтронів |
Загальна кількість електронів |
Кількість електронів на зовн. рівні |
Електронна формула |
|
К |
|
|
|
|
|
|
К+ |
|
|
|
|
|
|
О |
|
|
|
|
|
|
О2- |
|
|
|
|
|
V. Д/з. № § - це кількість електронів атома Алюміню, впр. № - це кількість протонів у ядрі Астату, кількість електронів у ядрі Францію, заряд ядра Радію.
Таблицю, якщо не встигли.
VI. Зворотній зв'язок.
Оцінити урок одним із трьох стікерів, і приєднати до однієї з колб.
(на дошці прикріпленні колби з написами чи формулами: кисень, вода, чадний газ. Якщо на уроці було цікаво і комфортно, то зелений стікер на зелену колбу з киснем, якщо нейтрально – на синю колбу з водою, якщо не сподобалось і не отримали нових знань – на червону колбу з чадним газом).
Вчитель пропонує зарядитися позитивним зарядом від протонів, які я вам підготувала. Електронні орбіталі вже відкриті, тому до ядра легко дістати. (круглі цукерки, які символізують позитивні протони)


про публікацію авторської розробки
Додати розробку