Урок "Реакції обміну між розчинами електролітів,умови їх перебігу. Йонно-молекулярні рівняння хімічних реакцій"
Урок 15
Тема уроку: «Реакції обміну між розчинами електролітів,умови їх перебігу. Йонно-молекулярні рівняння хімічних реакцій.»
Навчально-освітня мета: на основі сформованої предметної компетентності щодо реакцій йонного обміну між розчинами електролітів закріпити навички й уміння складати йонно-молекулярні рівняння в розчинах електролітів;
розвивати навички проведення хімічного експерименту на прикладі реакцій у розчинах електролітів;сформувати вміння передбачати оборотність хімічних реакцій;
- виховувати в учнів наполегливість, бажання до високої якості результатів.
Тип уроку: комбінований.
Основні терміни і поняття : розчини, електроліти, неелектроліти, електролітична дисоціація
Методи, прийоми і форми роботи: метод «практичність теорії», робота в групах, самостійна робота , лабораторні досліди,тренувальні вправи.
Навчальне обладнання: періодична система хімічних елементів Д.І. Менделєєва; таблиця розчинності солей, основ,кислот; хімічні реактиви; зошит для лабораторних дослідів.
Предметна компетентність: на основі сформованої предметної компетентності щодо реакцій йонного обміну між розчинами електролітів закріпити навички й уміння складати йонно-молекулярні рівняння в розчинах електролітів; розвивати навички проведення хімічного експерименту на прикладі реакцій у розчинах електролітів;сформувати вміння передбачати оборотність хімічних реакцій.
Ключова компетентність:спілкування державною мовою,математична компетентність.основні компетентності у природничих науках і технологіях,інформаційно–цифрова компетентність, соціальна та громадянська компетентність
Очікувані результати навчальних досягнень
Учень:
- Розпізнає, називає, дає визначення реакціям йонного обміну.
- Обґрунтовує суть реакцій йонного обміну
- Наводить приклади і записує реакції обміну в повній йонно-молекуляр-ній та скороченій йонно-молекулярній формах.
- Записує молекулярне рівняяння ,що відповідає скороченому йонно-молекулярному рівнянню.
ХІД УРОКУ
І. Організаційний момент.
Емоційне налаштування.
Вчитель: Наша радість і щастя складається з маленьких успіхів, перемог або просто з усмішок. Тому зараз пропоную всім посміхнутися.Бажаю вам попрацювати так, щоб наприкінці уроку прислухавшись до стану душі, ви посміхались.
ІІ. Актуалізація опорних знань.
а)Фронтальна бесіда (пригадайте):
1. Які реакції називаються реакціями йонного обміну?
2. За яких умов реакції йонного обміну відбуваються до кінця?
3. Яких правил потрібно дотримуватися під час запису йонно – молекулярних рівнянь реакцій?
4.Які речовини записуються в молекулярному вигляді, а які розкладаються на йони?
5. Чому під час печії люди вживають розчин питної соди?
б)Слайд-шоу Які реакції йонного обміну відбуваються до кінця?
(плеснути в долоні, якщо реакція йонного обміну можлива)
- Mn(NO3)2 + Ba(OH)2 = Mn(OH)2↓ + Ba(NO3)2;
- Na2S + H2SO4 = Na2SO4 + H2S↑;
- 2KOH + CO2 = K2CO3 + H2O;
- Na2SO4 + FeCl2 = 2 NaCl + FeSO4
- MgCl2 + 2 AgNO3 = Mg(NO3)2 + 2 AgCl↓
- CaCO3 + 2 HCl = CaCl2 + CO2↑ + H2O
в)Метод «Практичність теорії»
(Як роздатковий матеріал використовуємо етикетку від мінеральної води )

Зміст завдання:
- Виписати всі електроліти, які містить мінеральна вода;
- Написати рівняння дисоціації 2 електролітів;
- Які компоненти надають смак цій мінеральній воді?
- Чим корисна мінеральна вода?
ІІІ. Вивчення нового матеріалу
Розповідь учителя
а) Розглянемо рівняння оборотньої реакції:
2KNO3 + Na2SO4 → K2SO4 + 2NaNO3
В даному випадку хімічна реакція не відбувається і при змішуванні цих розчинів утворюється розчин, в якому незалежно один від одного існують катіони Натрію і Калію та нітрат і сульфат – аніони.Реакція оборотня.
б) Розглянемо рівняння реакції з утворенням малодисоційованої сполуки.
Взаємодія кислоти з лугом.
КOH + HNO3 → КNO3 + H2O
К+ + OH- + H+ + NO3 - → К++ NO3 -+ H2O
OH- + H+→ H2O
Реакція відбувається тому,що йони Гідрогену і гідроксид –іони сполучилися
, утворили воду,яка є неелектролітом.
в) Напишемо молекулярне рівняяння ,що відповідає такому скороченому йонно-молекулярному рівнянню.До запропонованого аніону ви повинні використавши таблицю розчинності кислот,основ та солей підібрати катіон , щоб утворилась розчинна сполука.І до запропонованого катіону ви повинні за тим же принципом підібрати аніон,щоб утворилась розчинна сполука.
OH- + H+→ H2O
ІV.Узагальнення та систематизація знань
1.Робота в групах. (формування вчителем груп та повторення правил техніки безпеки)
а)Лабораторний дослід 6. Реакції обміну в розчинах електролітів з утворенням води. Учні використовують зошит для лабораторних дослідів.Групам надано варіанти завдань.
1варіант. NaОH + HCl ![]()
2варіант. Cu(ОH)2 + H2SО4 ![]()
- Проведіть реакції між речовинами, відповідно до вашого варіанта
- Що спостерігаєте? Яка ознака вказує на те, що відбувається реакція?
- Користуючись таблицею розчинності, запишіть рівняння реакції у молекулярній, повній та скороченій йонно-молекулярних формах
- Запишіть висновок до лабораторного досліду №6.
б) Розв’язування тренувальних вправ
(самостійна робота).
1.Заповніть таблицю
|
Вихідні речовини |
Повне йонне рівняння |
Скорочене йонне рівняння |
|
І варіант FeCl3 і KOH |
|
|
|
ІІ варіант
|
|
H+ + OH- → H2O |
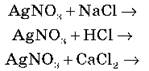 2. Запишіть рівняння в молекулярному вигляді:
2. Запишіть рівняння в молекулярному вигляді:
Чим відрізняються ці три рівняння? Що в них спільного?
VI. Підбиття підсумків уроку.Оцінювання учнів.Висновки
Письмова рефлексія «Дві найважливіші речі які я зрозумів або зрозуміла
на сьогоднішньому уроці»
VIIІ. Домашнє завдання. §11, Впр 83-85(за вибором), підготуватися до практичної роботи №1.


про публікацію авторської розробки
Додати розробку
